
- •Росжелдор
- •Введение: основные понятия и определения
- •Основы номенклатуры неорганических соединений можно изложить следующим образом:
- •1 Классы неорганических соединений
- •Растворимость солей, кислот и оснований в воде
- •2 Химическая термодинамика
- •3 Скорость химических реакций
- •3.1 Количественное определение скорости химической реакции
- •3.2 Влияние катализатора
- •4 Химическое равновесие
- •4.1 Понятие о химическом равновесии
- •4.2 Динамический характер и устойчивость химического равновесия
- •4.3 Константа химического равновесия
- •4.4 Положение равновесия и его зависимость от внешних факторов
- •4.4.1 Зависимость равновесия от концентрации
- •4.4.2 Зависимость равновесия от температуры
- •4.4.3 Влияние давления на равновесие
- •4.4.4 Влияние катализатора на равновесие
- •В выражение константы равновесия входят равновесные концентрации веществ:
- •5 Строение электронных оболочек атомов. Периодический закон д.И. Менделеева
- •6 Химическая связь и строение молекул
- •7 Растворы
- •7.1 Способы выражения концентрации растворов
- •7.2 Физико-химические свойства разбавленных растворов неэлектролитов. Давление пара растворов. Закон Рауля
- •7.2.1 Понижение температуры замерзания и повышение температуры кипения растворов (следствия из закона Рауля)
- •7.3 Растворы электролитов
- •7.4 Ионное произведение воды. Водородный показатель рН
- •8 Окислительно-восстановительные реакции
- •9 Гальванические элементы
- •9.1 Понятие об электродном потенциале
- •9.2 Гальванический элемент
- •10 Коррозия металлов
- •10.1 Защита от коррозии
- •11 Электролиз
- •11.1 Катодные процессы
- •11.2 Анодные процессы
- •12 Полимеры
- •12.1 Реакция полимеризации
- •12.2 Реакция поликонденсации
- •12.3 Полимерные материалы
- •13 Дисперсные системы
- •14 Химический анализ
- •Библиографический список
- •Содержание
- •Мигаль Юрий Фёдорович
7.3 Растворы электролитов
В
растворах электролитов число частиц
растворенного вещества больше, чем в
растворах неэлектролитов той же
концентрации за счет процесса
электролитической диссоциации. Поэтому
для растворов электролитов значения
величин ΔР,
Δtкип,
Δtзам
более
высокие, чем для растворов неэлектролитов.
Отношение
найденных опытным путем значений
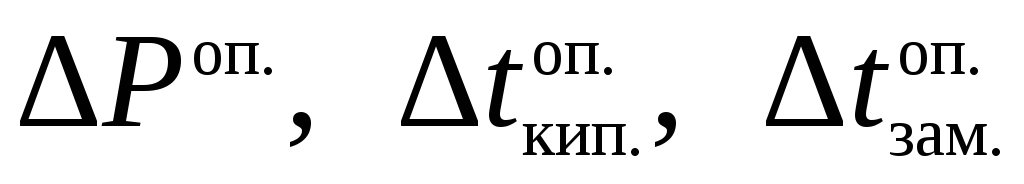 для электролитов
к вычисленным теоретически без учета
диссоциации называется
изотоническим
коэффициентом (i):
для электролитов
к вычисленным теоретически без учета
диссоциации называется
изотоническим
коэффициентом (i):
|
|
|
(7.16) |
Изотонический коэффициент i показывает, во сколько раз увеличилось число частиц в растворе электролита за счет электролитической диссоциации. Для растворов неэлектролитов i = 1. Степенью диссоциации (α) называется отношение числа молекул, продиссоциировавших на ионы, к общему числу молекул электролита в растворе. По степени диссоциации все электролиты делятся на сильные (α > 30 %) и слабые (α < 30 %). Очень сильные электролиты в водных растворах практически полностью диссоциируют на ионы, процесс их диссоциации необратим:
МА = М+ + А–.
Для слабых электролитов диссоциация – процесс обратимый. Поэтому в растворе между ионами и недиссоциированными молекулами устанавливается равновесие, подчиняющееся закону действующих масс.
МА М+ + А–
Для равновесия диссоциации запишем выражение для константы равновесия, которая называется константой диссоциации К:
|
|
|
(7.17) |
Константа диссоциации определяет полноту протекания процесса электролитической диссоциации при данной температуре, способность электролита распадаться на ионы. Чем меньше значение К, тем слабее электролит.
Константа диссоциации К и степень диссоциации α связанны соотношением (7.18) (закон разбавления Оствальда):
|
|
|
(7.18) |
где С – молярная концентрация электролита, моль/л.
При
бесконечном разбавлении раствора
электролита (![]() )
степень диссоциации
должна стремиться к единице для
сохранения постоянства величины K.
Это составляет суть закона разбавления
Оствальда: при уменьшении концентрации
электролитов (разбавлении раствора)
все электролиты становятся сильными
(
)
степень диссоциации
должна стремиться к единице для
сохранения постоянства величины K.
Это составляет суть закона разбавления
Оствальда: при уменьшении концентрации
электролитов (разбавлении раствора)
все электролиты становятся сильными
(![]() ).
).
При малых значениях α можно принять (1 – α) ≈ 1. Тогда выражение (7.18) упрощается:
|
|
|
(7.19) |
Между изотоническим коэффициентом i, степенью диссоциации α и числом ионов β, на которые распадается молекула электролита при ее диссоциации в растворе, существуют соотношения:
|
|
|
(7.20) |
С учетом диссоциации электролитов, закон Рауля и следствия из него формулы (7.11) и (7.12) для растворов электролитов приобретают вид (7.21) – (7.23):
|
|
|
(7.21) |
|
|
Δtкип = i∙E∙Cm, |
(7.22) |
|
|
Δtзам = i ∙K∙Cm . |
(7.23) |
Пример 8. При растворении 12 г NaOH в 100 г воды температура кипения составила 102,65 ˚С. Вычислить степень диссоциации NaOH в этом растворе.
Решение
Используя формулу (7.22),
![]() ,
,
определим изотонический коэффициент
![]() ,
,
Подставляя числовые значения в приведенную формулу, имеем:
Δtкип =102,65 – 100 = 2,65 ˚С.
![]() .
.
Определим степень диссоциации α по формуле (7.20):
NaOH Na+ + OH–, βNaOH = 2.

Пример 9. Константа диссоциации циановодорода равна 7,9∙10–10. Найти степень диссоциации НСN в 0,001 М растворе.
Решение
Поскольку константа диссоциации HCN очень мала, то для расчета можно использовать формулу (7.19):
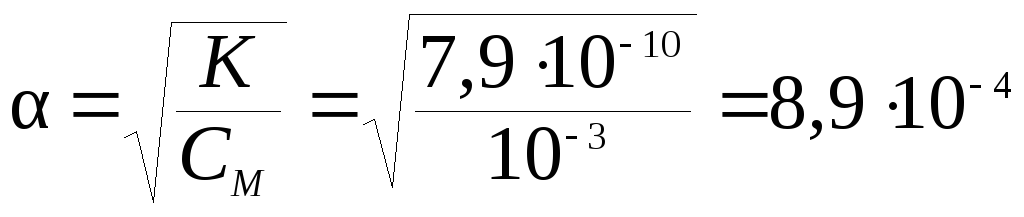 .
.


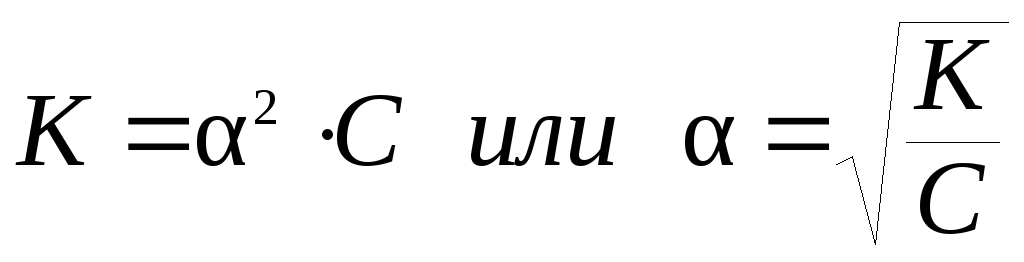 .
.
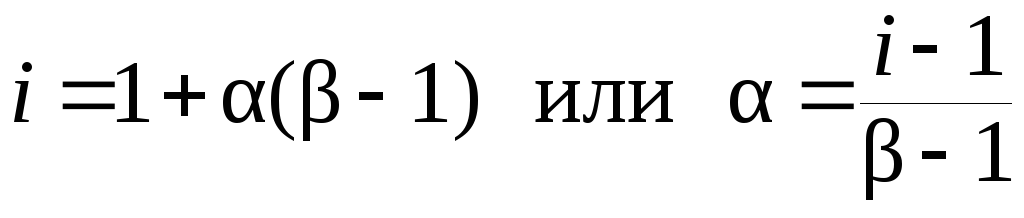 .
.