
- •Росжелдор
- •Введение: основные понятия и определения
- •Основы номенклатуры неорганических соединений можно изложить следующим образом:
- •1 Классы неорганических соединений
- •Растворимость солей, кислот и оснований в воде
- •2 Химическая термодинамика
- •3 Скорость химических реакций
- •3.1 Количественное определение скорости химической реакции
- •3.2 Влияние катализатора
- •4 Химическое равновесие
- •4.1 Понятие о химическом равновесии
- •4.2 Динамический характер и устойчивость химического равновесия
- •4.3 Константа химического равновесия
- •4.4 Положение равновесия и его зависимость от внешних факторов
- •4.4.1 Зависимость равновесия от концентрации
- •4.4.2 Зависимость равновесия от температуры
- •4.4.3 Влияние давления на равновесие
- •4.4.4 Влияние катализатора на равновесие
- •В выражение константы равновесия входят равновесные концентрации веществ:
- •5 Строение электронных оболочек атомов. Периодический закон д.И. Менделеева
- •6 Химическая связь и строение молекул
- •7 Растворы
- •7.1 Способы выражения концентрации растворов
- •7.2 Физико-химические свойства разбавленных растворов неэлектролитов. Давление пара растворов. Закон Рауля
- •7.2.1 Понижение температуры замерзания и повышение температуры кипения растворов (следствия из закона Рауля)
- •7.3 Растворы электролитов
- •7.4 Ионное произведение воды. Водородный показатель рН
- •8 Окислительно-восстановительные реакции
- •9 Гальванические элементы
- •9.1 Понятие об электродном потенциале
- •9.2 Гальванический элемент
- •10 Коррозия металлов
- •10.1 Защита от коррозии
- •11 Электролиз
- •11.1 Катодные процессы
- •11.2 Анодные процессы
- •12 Полимеры
- •12.1 Реакция полимеризации
- •12.2 Реакция поликонденсации
- •12.3 Полимерные материалы
- •13 Дисперсные системы
- •14 Химический анализ
- •Библиографический список
- •Содержание
- •Мигаль Юрий Фёдорович
7.2 Физико-химические свойства разбавленных растворов неэлектролитов. Давление пара растворов. Закон Рауля
Давление насыщенного пара растворов нелетучих веществ ниже давления насыщенного пара чистого растворителя при той же температуре. Понижение давления пара объясняется тем, что поверхность раствора частично занята сольватированными молекулами растворенного вещества, благодаря чему уменьшается концентрация самого растворителя и способность его к испарению.
Если обозначить давление пара растворителя через Р0, а раствора через Р, то разность (Р0 – Р) = ΔР, отнесенная к Р0, называется относительным понижением давления насыщенного пара растворителя над раствором (ΔР/Р0). Согласно закону Рауля, относительное понижение давления насыщенного пара растворителя над раствором равно молярной доле растворенного вещества:
|
|
|
(7.7) |
где N – число молей растворителя,
n – число молей растворенного вещества
Число молей определяется отношением массы вещества к его молярной массе.
|
|
|
(7.8) |
Для разбавленных растворов количество вещества растворителя во много раз больше, чем количество растворенного вещества (N >> n), поэтому величиной n в знаменателе в выражении (7.7) можно пренебречь, и уравнение принимает вид (7.9):
|
|
|
(7.9) |
Давление пара раствора связано с давлением пара растворителя следующим соотношением:
|
|
|
(7.10) |
Пример 6. Сколько граммов метанола (СН3ОН) необходимо растворить в 360 г воды, чтобы давление пара раствора при 15 ˚С было 1200 Па? Давление паров при этой температуре равно 1227,8 Па.
Решение
Находим величину понижения давления пара ΔР:
ΔР = Р0 – Р = 1227,8 – 1200 = 27,8 Па,
молярные массы метанола и воды
М(СН3ОН) = 32 г/моль; М(Н2О) = 18 г/моль,
и выражаем число молей растворенного вещества n и растворителя N:
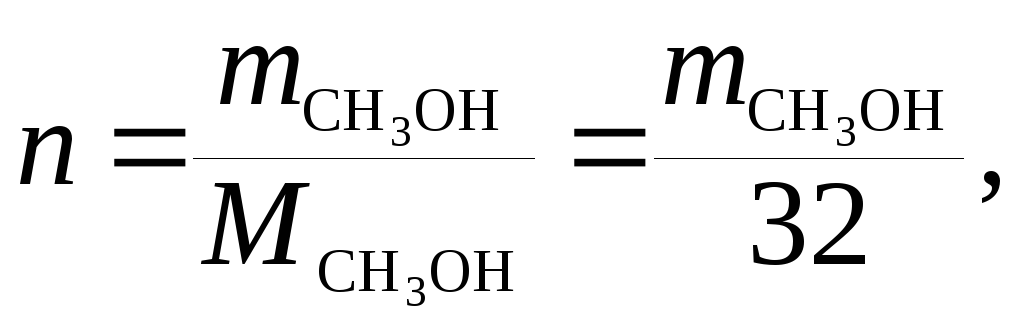
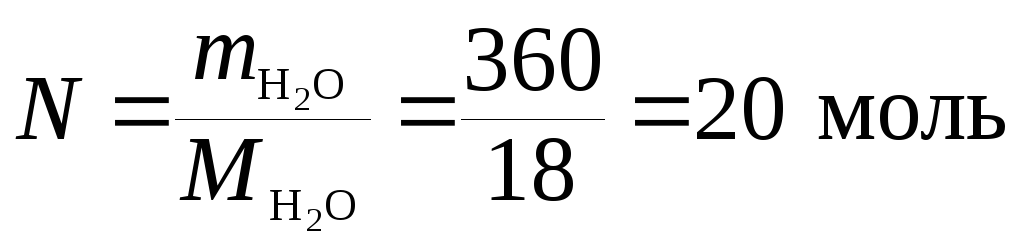 .
.
Подставив данные в формула (7.7), находим:
![]()
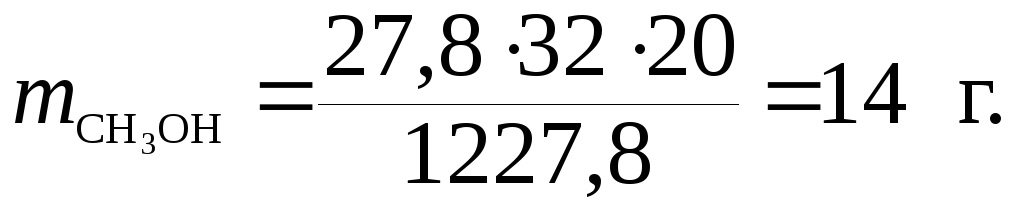
7.2.1 Понижение температуры замерзания и повышение температуры кипения растворов (следствия из закона Рауля)
Из закона Рауля вытекают два следствия: растворы кипят при более высоких и замерзают при более низких температурах, чем чистый растворитель. Причем величины повышения температуры кипения Δtкип и понижения температуры замерзания Δtзам разбавленных растворов неэлектролитов пропорциональны моляльной концентрации растворенного вещества:
|
|
Δtкип = Е∙Сm, |
(7.11) |
|
|
Δtзам = К∙Сm, |
(7.12) |
где Е – эбуллиоскопическая постоянная;
К – криоскопическая постоянная;
Сm – моляльная концентрация, то есть число молей растворенного вещества на 1 кг растворителя.
|
|
|
(7.13) |
где mА – масса растворенного вещества, г;
МА – молярная масса растворенного вещества, г/моль;
mB – масса растворителя, г;
1000 – переводной коэффициент от граммов к килограммам.
Е и К – величины, постоянные для каждого растворителя, определяются только его природой и не зависят от свойств растворенного вещества. Физический смысл постоянных Е и К выявляется при условии, что Сm = 1 моль/кг. Тогда из (7.11) и (7.12) следует что Δtкип = Е и Δtзам = К. Следовательно, Е – это повышение температуры кипения, К – понижение температуры замерзания одномоляльного раствора. Для водных растворов Е = 0,52 ˚ С∙кг/моль, а К = 1,86 ˚С∙кг/моль.
Уравнения (7.11) и (7.12) можно применить для определения молярных масс веществ, подставив вместо Сm соответствующие выражения, тогда:
|
|
|
(7.14) |
|
|
|
(7.15) |
Пример 7. При какой температуре будет кипеть и замерзать 10 %-ный раствор уксусной кислоты (СН3СООН)?
Решение
1 Находим массу и молярную массу растворенного вещества и массу воды (растворителя).
Для 10 %-го раствора:
mА = 10 г СН3СООН, mВ = 90 г Н2О.
Молярная масса уксусной кислоты M(СН3СООН ) = 60 г/моль.
2 Применяя формулы (7.11) и (7.12), рассчитываем:
![]() ˚С,
˚С,
t˚кип. р-ра. = t˚кип.воды + Δtкип = 100 + 0,96 = 100,96 ˚С.
3 Из формулы (7.12) следует:
![]() ˚С
˚С
t˚зам.р-ра = t˚зам.воды – tзам. = 0 – 3,44 = –3,44 ˚С.
