
- •Міністерство освіти і науки України
- •1 Програма з розділу «загальні основи аналітичної хімії»
- •Тема 1. 1 Предмет загальної, неорганічної та аналітичної хімії. Значення дисципліни для підготовки товарознавця. Найважливіші поняття та закони загальної хімії, які потрібні для вивчення курсу
- •Тема1.2 Періодичний закон та періодична система елементів
- •Тема 1.3 Сучасні теорії будови атомів та хімічного зв’язку як основа вивчення хіміко-аналітичних і фізичних властивостей сировини та матеріалів
- •Тема 1.4 Швидкість та механізм хімічних реакцій
- •Тема 1.5 Розчини та теорія електролітичної дисоціації
- •Тема 1.6 Рівновага у розчинах солей, які піддаються гідролізу
- •Тема 1.7 Рівновага у розчинах малорозчинних сполук
- •Тема 1.8 Рівновага у розчинах координаційних (комплексних) сполук
- •Тема 1.9 Рівновага при перебігу окисно-відновних реакцій (овр)
- •Тема 1.10 Систематичний аналіз катіонів та аніонів
- •Тема 1.11 Органічні аналітичні реагенти
- •Тема 1.12 Теорія та практика відбирання проби та її підготовка
- •Тема 1.13 Методи розподілу і концентрування
- •Тема 1.14 Об’ємний (титриметричний) аналіз
- •Тема 1.15 Гравіметричний (ваговий) аналіз
- •Студент повинен вміти:
- •Додаткова
- •Методичні матеріали
- •2 Приклади рішення типових задач. Питання та задачі до контрольних робіт
- •2.1 Приклади рішення типових задач з теми
- •2.2 Питання та задачі до контрольних робіт з теми
- •2.3. Приклади рішення типових задач з теми
- •2.4 Питання та задачі до контрольних робіт з теми
- •2.5 Приклади рішення типових задач з теми
- •2.6 Питання та задачі до контрольних робіт з теми
- •2.7 Приклади рішення типових задач з теми “Хімічний зв’язок”
- •2.8 Питання та задачі до контрольних робіт з теми “Хімічний зв’язок”
- •2.9 Приклади рішення типових задач з теми
- •2.10 Питання та задачі до контрольних робіт з теми
- •2.11 Приклади рішення типових задач з теми
- •2.12 Питання та задачі до контрольних робіт з теми
- •2.13 Приклади рішення типових задач з теми
- •2.14 Питання та задачі до контрольних робіт з теми
- •2.15 Приклади рішення типових задач з теми
- •2.16 Питання та задачі до контрольних робіт з теми
- •2.17 Приклади рішення типових задач з теми
- •2.18 Питання та задачі до контрольних робіт з теми
- •2.19 Приклади рішення типових задач з теми
- •2.20 Питання та задачі до контрольних робіт з теми
- •2.21 Приклади рішення типових задач з теми
- •2.22 Питання та задачі до контрольних робіт з теми
- •3. Варіанти контрольних робіт
2.13 Приклади рішення типових задач з теми
“Рівновага у розчинах солей, які піддаються гідролізу”
Приклад
1.
У розчинах яких солей
![]() :
а)
:
а)
![]() ;
б)
;
б)
![]() ;
в)
;
в)
![]() .
.
Розв’язання:
Гідроліз солі це взаємодія солі з водою, при якій складові частини солі з’єднуються зі складовими частинами води.
а)
натрій нітрат
сіль, яка утворена сильним лугом ![]() та слабкою кислотою
та слабкою кислотою ![]() ,
тому вона гідролізується:
,
тому вона гідролізується:
![]()
![]()
Розчин
солі буде мати лужне середовище ![]()
б)
купрум(II)
сульфат
сіль утворена слабкою основою
![]() та сильною кислотою
та сильною кислотою![]() .
Це означає, що гідроліз цієї солі буде
проходити по катіону. Катіон двохзарядний,
тому гідроліз буде проходити за ступенями:
.
Це означає, що гідроліз цієї солі буде
проходити по катіону. Катіон двохзарядний,
тому гідроліз буде проходити за ступенями:
![]()
![]() .
.
Розчин
солі буде мати кисле середовище ![]() .
.
в)
калій сульфат
сіль утворена лугом ![]() та сильною кислотою
та сильною кислотою ![]() ,
тому ця сіль гідролізу не підлягає. При
розчиненні солі відбувається тільки
її дисоціація:
,
тому ця сіль гідролізу не підлягає. При
розчиненні солі відбувається тільки
її дисоціація:
![]()
Розчин
солі буде мати нейтральне середовище
![]() .
.
2.14 Питання та задачі до контрольних робіт з теми
“Рівновага у розчинах солей, які піддаються гідролізу”
|
№ |
Які з наведених солей гідролізуються? Напишіть іонні та молекулярні рівняння реакцій. Укажіть середовище цих розчинів. |
|
|
211 |
| |
|
212 |
| |
|
213 |
| |
|
214 |
| |
|
215 |
| |
|
216 |
| |
|
217 |
| |
|
218 |
| |
|
219 |
| |
|
220 |
|
.
Продуктом гідролізу яких солей є основні солі: а)
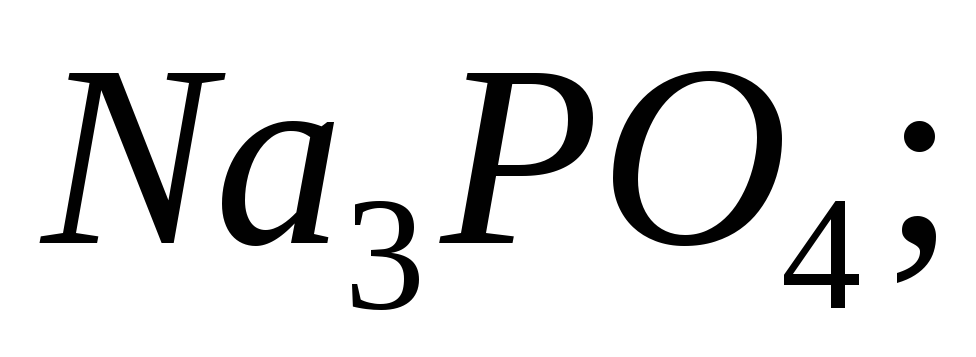 б)
б) 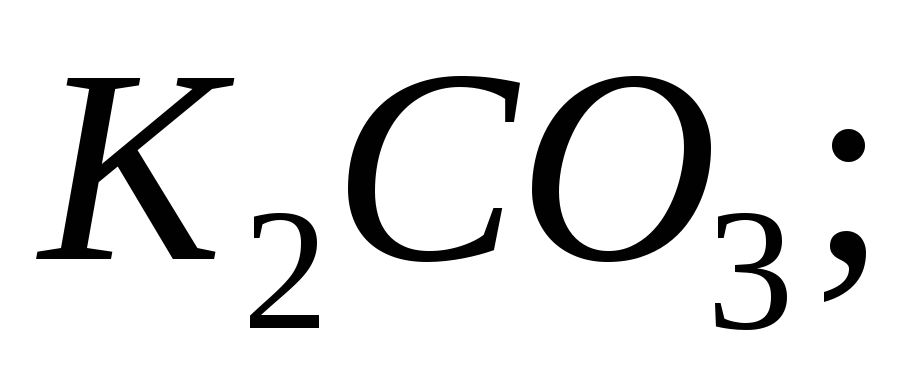
в)
![]() ;
г)
;
г) ![]() Напишіть
іонні реакції їх гідролізу.
Напишіть
іонні реакції їх гідролізу.
Для розчинів яких солей рН має таке ж значення, як для води? Покажіть це на прикладі
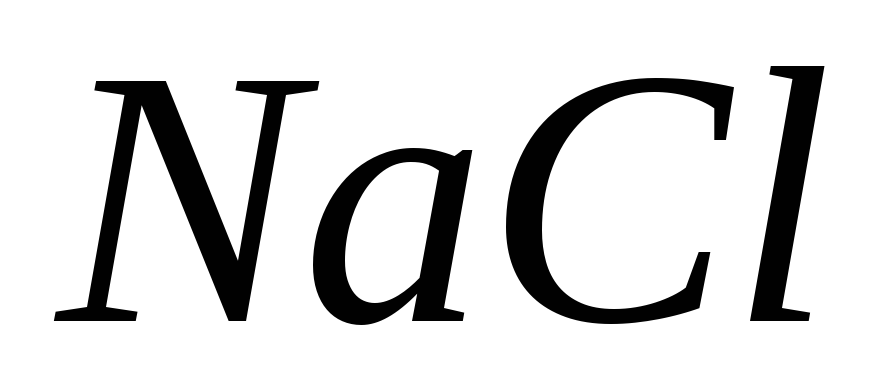 та
та 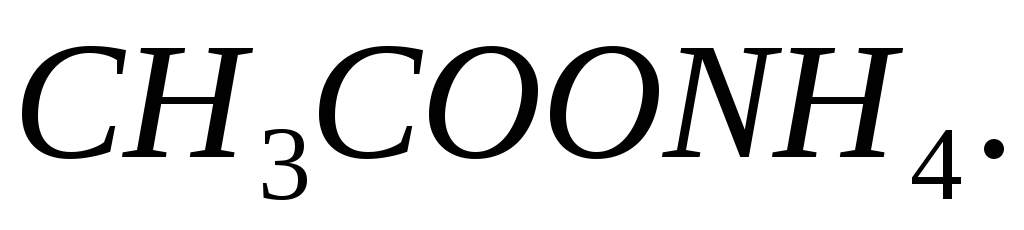
Чи можна за допомогою індикатору відрізнити друг від друга солі:
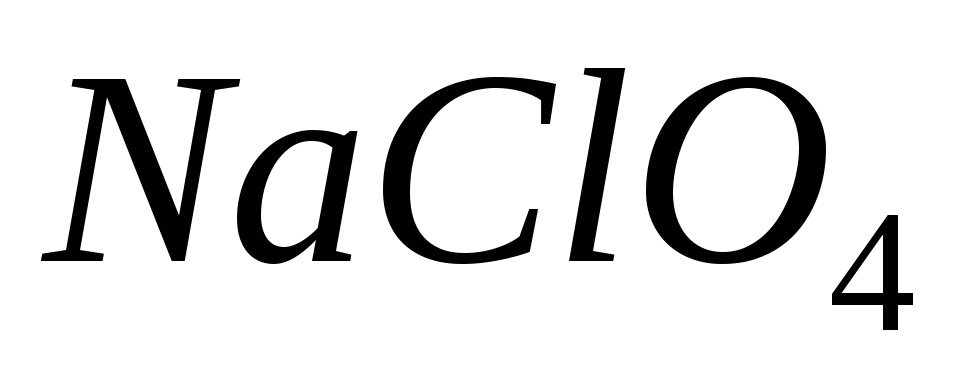 і
і
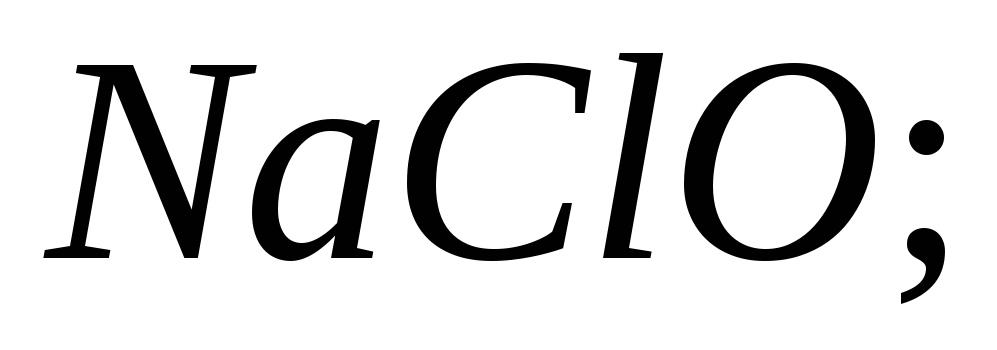
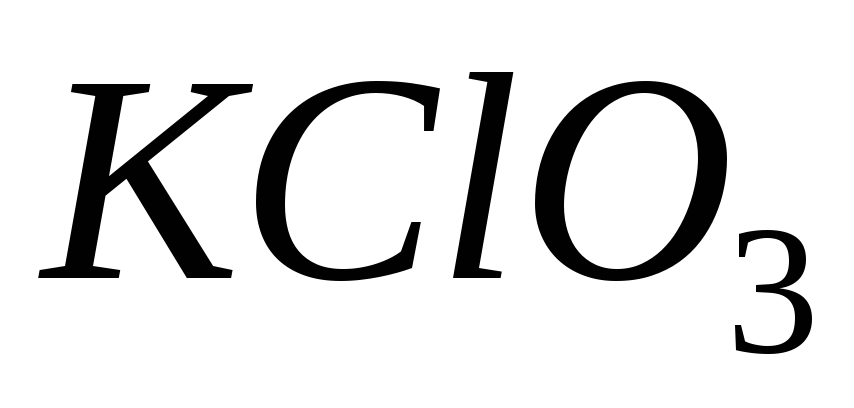 і
і
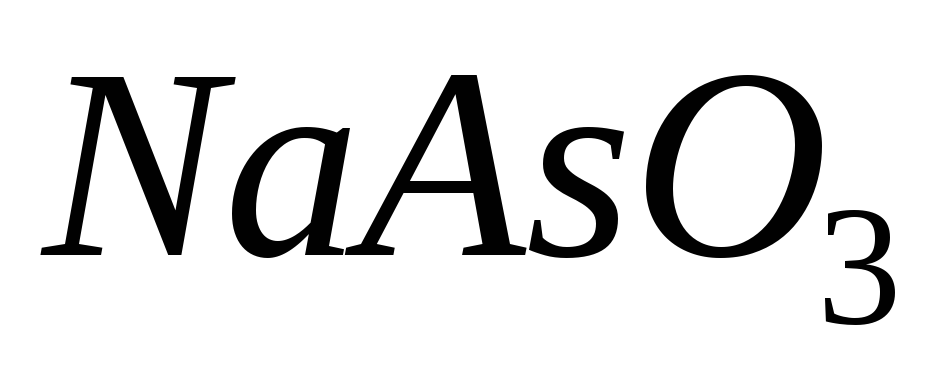 ;
;
 і
і
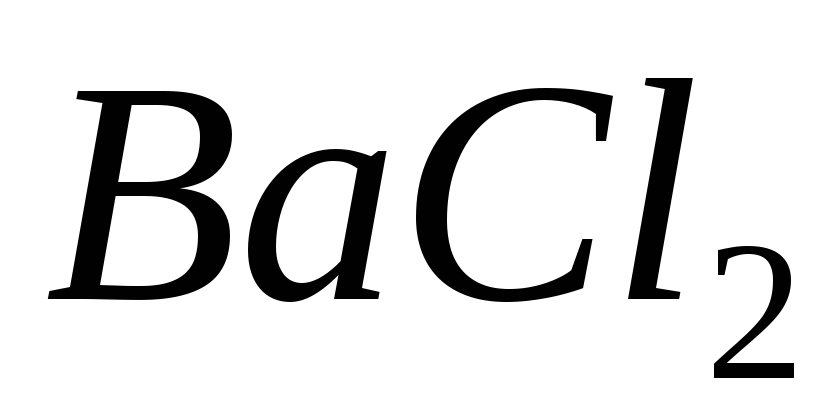 ;
;
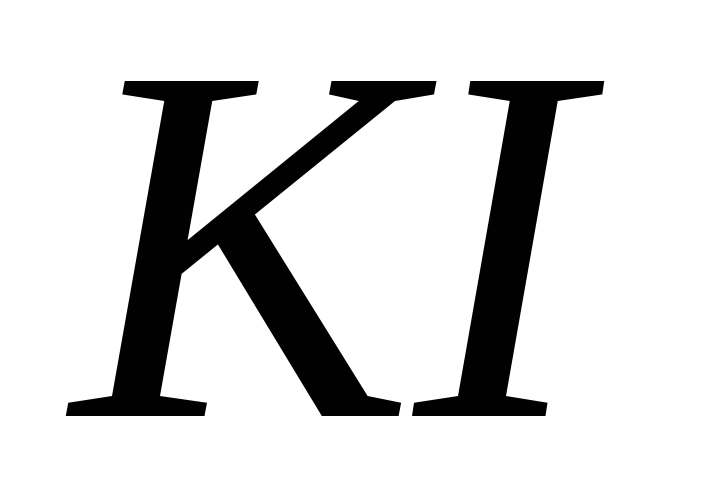 і
і
 ;
;
 і
і

Чи можна за допомогою індикатору відрізнити друг від друга солі:
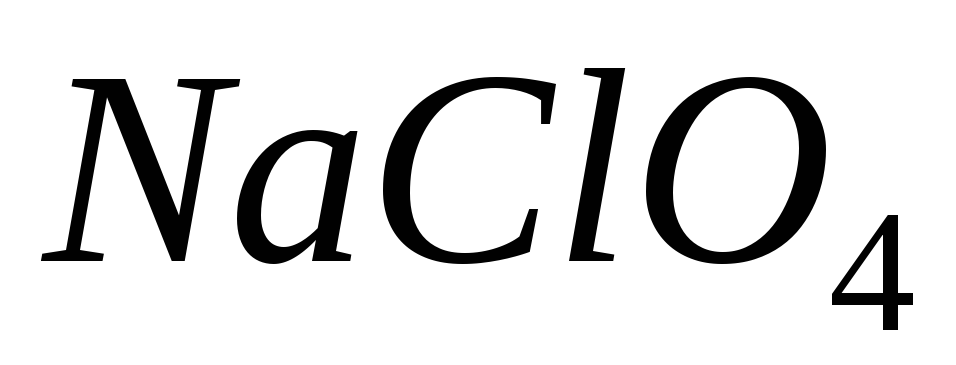 і
і
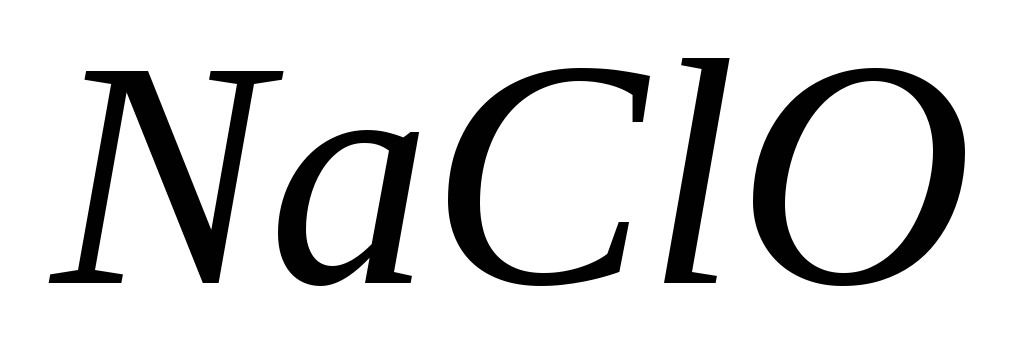 ;
;
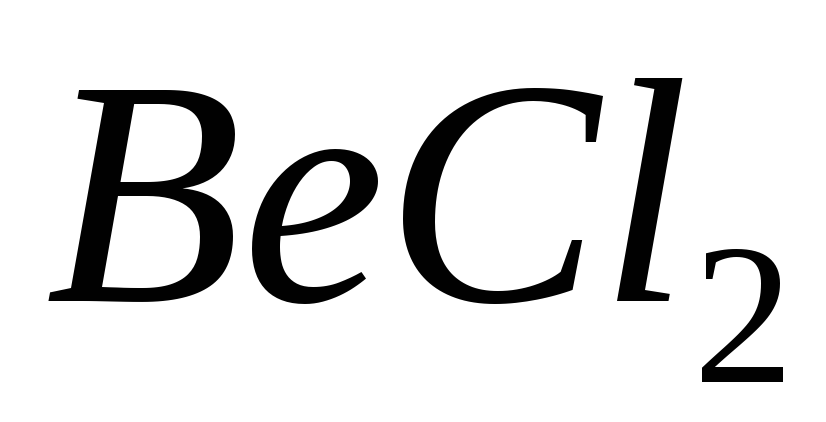 і
і
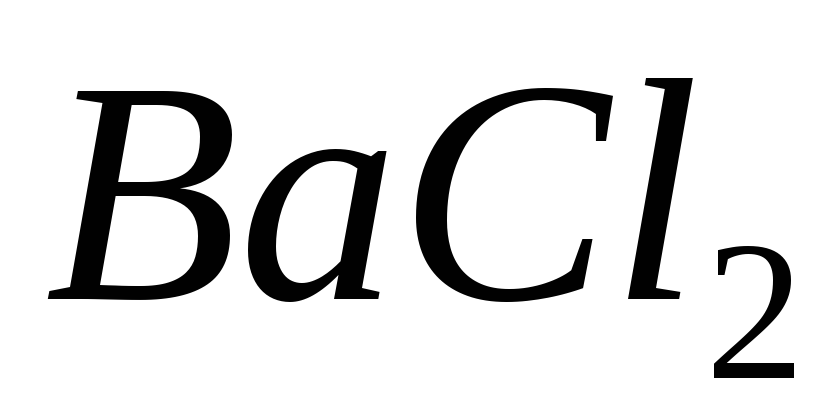 ;
;
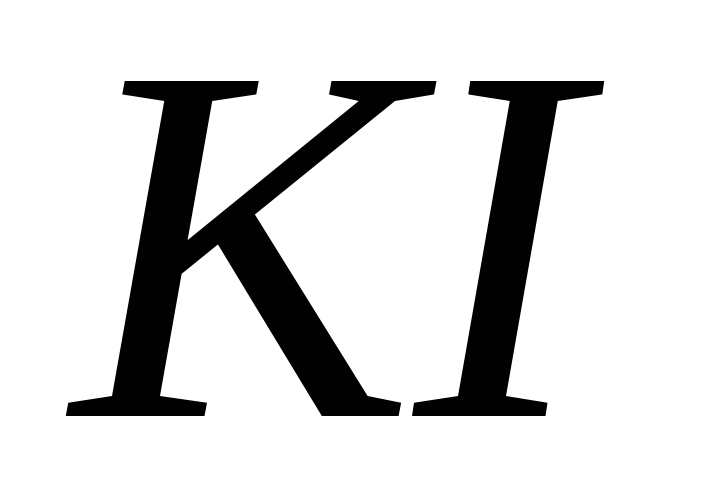 і
і
 ;
;
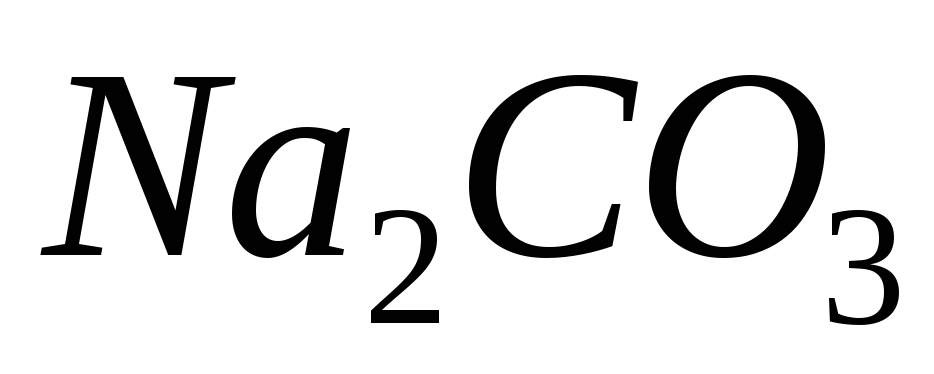 і
і
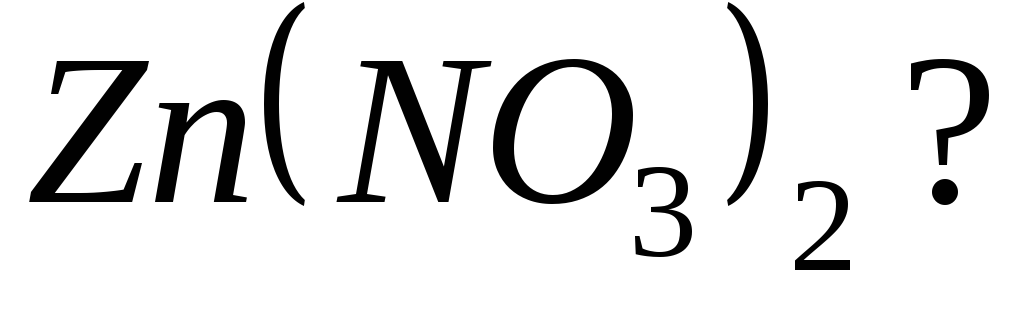
225. Для якої солі
![]() буде мати більше значення:
буде мати більше значення:
![]() чи
чи
![]() ,
,
![]() чи
чи
![]() ,
,
![]() чи
чи
![]()
2.15 Приклади рішення типових задач з теми
“ Рівновага у розчинах координаційних (комплексних) сполук ”
Приклад
1.
Дайте назву
комплексним сполукам а)![]() ;
б)
;
б)![]() ,
визначте ступінь окиснення і координаційне
число комплексо-утворювача. Напишіть
для них рівняння дисоціації та константи
нестійкості.
,
визначте ступінь окиснення і координаційне
число комплексо-утворювача. Напишіть
для них рівняння дисоціації та константи
нестійкості.
Розв’язання:
а)![]()
Назва: тетраамінкупрум(II)нітрат.
Комплексоутворювач:
![]() .
.
Ступінь окиснення комплексоутворювача: +2.
Координаційне число комплексоутворювача: 4.
Дисоціація:
1. Первинна:
![]()
![]() .
.
2.Вторинна:
![]() .
.
Запишемо вираз для константи нестійкості комплексного іону
![]() :
:
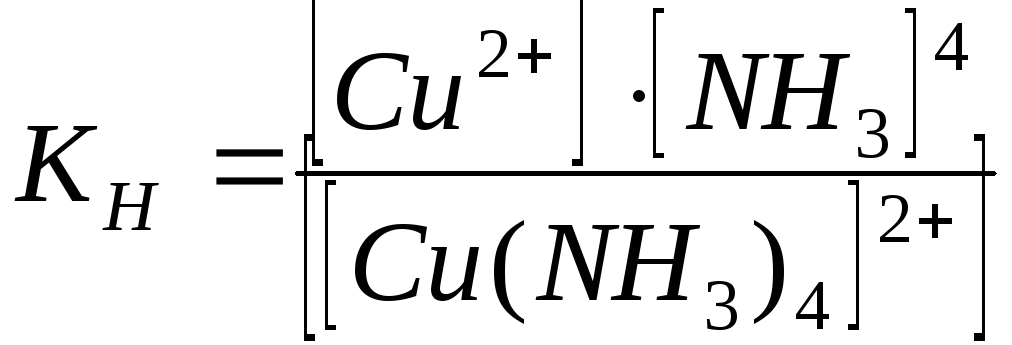
б)![]()
Назва: гідроген
тетрахлороаурат
![]() .
.
Комплексоутворювач: Au.
Ступінь окиснення комплексоутворювача: +5.
Координаційне число комплексоутворювача: 4.
Дисоціація:
1. Первинна:
![]() .
.
2.Вторинна:
![]() .
.
Запишемо
вираз для константи нестійкості
комплексного іону
![]() :
:
 .
.
2.16 Питання та задачі до контрольних робіт з теми
“Рівновага у розчинах координаційних (комплексних) сполук”
Опишіть будову комплексної сполуки на прикладі калій гексаціаноферрату(ІІІ)?
які фактори впливають на стійкість комплексних сполук?
які принципи можуть лежати в основі класифікації комплексних сполук?
що таке іонний асоціат? Навести приклади.
назвіть основні типи комплексних сполук?
навести приклади зовнішньо- та внутришньосферних комплексних сполук?
що таке однороднолігандні та різнолігандні комплекси?
що називається поліядерними сполуками?
як впливає електронна конфігурація центрального атома на стереохімію комплексної сполуки? Навести приклади.
Що таке координаційне число? Що таке максимальне та характеристичне координаційне комплексне число?
що визначає дентатність ліганду? Навести приклади моно- та полідентатних лігандів.
що таке хелат? У чому полягає сутність хелатного ефекту?
які сполуки називаються внутришньокомплексними? Навести приклади.
навести приклади координаційно-насичених та координаційно-ненасичених комплексних сполук.
які рівноваги мають місце в розчинах комплексних сполук? Як можна охарактеризувати ці рівноваги?
що таке ступінчасті та загальні константи стійкості комплексної сполуки?
що таке середнє лігандне число, та що воно характеризує?
як можна стабілізувати сполуку з нестійкими ступенями окиснення елементу? Покажіть це на прикладах кобальту(ІІІ) та купруму(І).
дайте теоретичне обґрунтування (проілюструйте розрахунками) можливості використання комплексних сполук для вибіркового розчинення та осадження малорозчинних сполук.
які властивості комплексних сполук мають найбільш велике значення для відкриття та розділення іонів?
наведіть приклади використання реакції комплексоутворення для розчинення:
меркурій(II) та кадмій(II) сульфідів;
барій та плюмбум сульфатів;
аргентум та меркурій(І) хлоридів;
цинк(II), нікол(II), кобальт(II) та алюміній(III) фосфатів.
Дайте теоретичне обґрунтування схеми розділення плюмбум(II) хлориду, аргентум(I) хлориду та меркурій(І) хлориду.
Наведіть приклади використання реакцій комплексоутворення для розділення:
кальцій(II)- та стронцій(II)-іонів;
кальцій(II)- та магній(II)-іонів;
нікол(II)- та кобальт(II)-іонів;
алюміній(III)- та ферум(II)-іонів;
купрум(III)- та кадмій(II)-іонів;
аргентум(I)- та меркурій(I)-іонів;
плюмбум(II)- та барій(II)-іонів.
наведіть приклади використання комплексних сполук при відкритті елементів.
наведіть приклади використання реакцій комплексоутворення для маскування іонів, які заважають відкриттю кобальт(II)-, нікол(II)-, алюміній(III)-, кадмій(II)-іонів.
наведіть приклади використання комплексоутворення для зміни кислотно–основних властивостей сполук.
Дайте назву комплексним сполукам, визначте ступінь окиснення та координаційне число комплексоутворювача. Напишіть для них рівняння дисоціації та константи нестійкості.
|
№ |
Комплексні сполуки |
|
252 |
|
|
253 |
|
|
254 |
|
|
255 |
|
|
256 |
|
|
257 |
|
|
258 |
|
|
259 |
|
|
260 |
|
|
261 |
|
|
262 |
|
|
263 |
|
264. На які іони в водних
розчинах повністю дисоціюють комплексні
сполуки, склад яких виражається наступними
молекулярними формулами:
![]() ;
;
![]() ;
;
![]() ;
;
![]() ?
?
265. На які іони в водних розчинах повністю
дисоціюють комплексні сполуки, склад
яких виражається наступними молекулярними
формулами:
![]() ;
;
![]() ;
;
![]() .
.
266. Як за значеннями константи стійкості чи константи нестійкості визначається відносна міцність однотипних комплексних сполук?
267. Напишіть рівняння утворення
комплексних кислот та основ при взаємодії:
![]() та
та
![]() ;
;
![]() та
та
![]() ;
;
![]() та
та
![]() ;
;
![]() та
та
![]() .
.
268. Напишіть рівняння утворення
комплексних кислот та основ при взаємодії:
![]() та
та
![]() ;
;
![]() та
та
![]() ;
;
![]() та
та
![]() ;
PtCl4
та
;
PtCl4
та
![]() .
.
269. Дисоціація комплексних
іонів звичайно дається сумарним
рівнянням. Покажіть ступінчастий
характер цього процесу на прикладах
дисоціації комплексів
![]() та
та
![]() .
Чим визначається число ступеней?
.
Чим визначається число ступеней?
Характеристиками яких процесів являються константа нестійкості та константа стійкості комплексу? Як вони пов’язані між собою? Напишіть їх вирази для сполук:
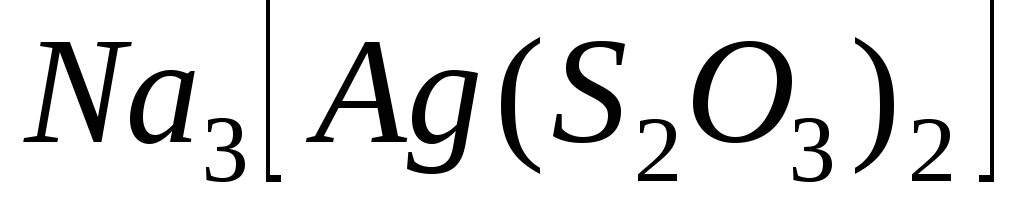 ;
;
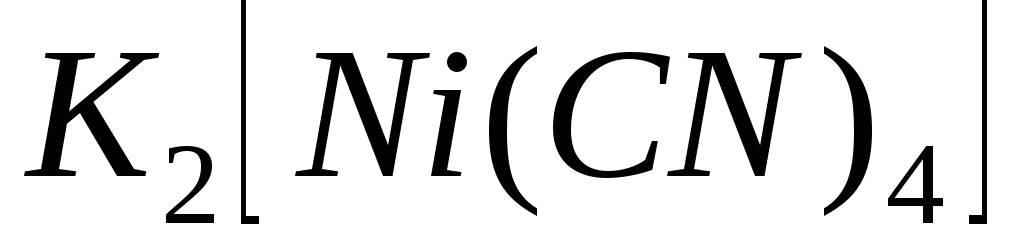 ;
;
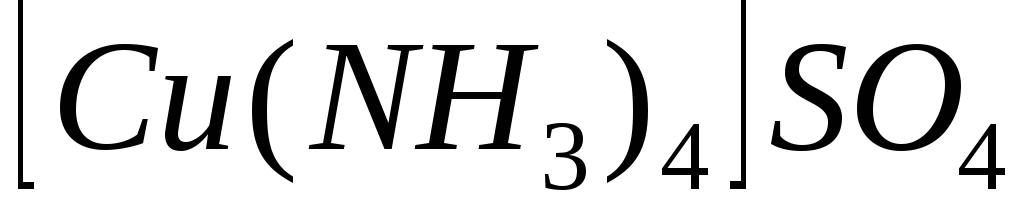 .
.
