
- •Міністерство освіти і науки України
- •1 Програма з розділу «загальні основи аналітичної хімії»
- •Тема 1. 1 Предмет загальної, неорганічної та аналітичної хімії. Значення дисципліни для підготовки товарознавця. Найважливіші поняття та закони загальної хімії, які потрібні для вивчення курсу
- •Тема1.2 Періодичний закон та періодична система елементів
- •Тема 1.3 Сучасні теорії будови атомів та хімічного зв’язку як основа вивчення хіміко-аналітичних і фізичних властивостей сировини та матеріалів
- •Тема 1.4 Швидкість та механізм хімічних реакцій
- •Тема 1.5 Розчини та теорія електролітичної дисоціації
- •Тема 1.6 Рівновага у розчинах солей, які піддаються гідролізу
- •Тема 1.7 Рівновага у розчинах малорозчинних сполук
- •Тема 1.8 Рівновага у розчинах координаційних (комплексних) сполук
- •Тема 1.9 Рівновага при перебігу окисно-відновних реакцій (овр)
- •Тема 1.10 Систематичний аналіз катіонів та аніонів
- •Тема 1.11 Органічні аналітичні реагенти
- •Тема 1.12 Теорія та практика відбирання проби та її підготовка
- •Тема 1.13 Методи розподілу і концентрування
- •Тема 1.14 Об’ємний (титриметричний) аналіз
- •Тема 1.15 Гравіметричний (ваговий) аналіз
- •Студент повинен вміти:
- •Додаткова
- •Методичні матеріали
- •2 Приклади рішення типових задач. Питання та задачі до контрольних робіт
- •2.1 Приклади рішення типових задач з теми
- •2.2 Питання та задачі до контрольних робіт з теми
- •2.3. Приклади рішення типових задач з теми
- •2.4 Питання та задачі до контрольних робіт з теми
- •2.5 Приклади рішення типових задач з теми
- •2.6 Питання та задачі до контрольних робіт з теми
- •2.7 Приклади рішення типових задач з теми “Хімічний зв’язок”
- •2.8 Питання та задачі до контрольних робіт з теми “Хімічний зв’язок”
- •2.9 Приклади рішення типових задач з теми
- •2.10 Питання та задачі до контрольних робіт з теми
- •2.11 Приклади рішення типових задач з теми
- •2.12 Питання та задачі до контрольних робіт з теми
- •2.13 Приклади рішення типових задач з теми
- •2.14 Питання та задачі до контрольних робіт з теми
- •2.15 Приклади рішення типових задач з теми
- •2.16 Питання та задачі до контрольних робіт з теми
- •2.17 Приклади рішення типових задач з теми
- •2.18 Питання та задачі до контрольних робіт з теми
- •2.19 Приклади рішення типових задач з теми
- •2.20 Питання та задачі до контрольних робіт з теми
- •2.21 Приклади рішення типових задач з теми
- •2.22 Питання та задачі до контрольних робіт з теми
- •3. Варіанти контрольних робіт
Студент повинен вміти:
1. Самостійно працювати з навчальною та довідковою літературою.
2. Працювати з хімічним посудом та реактивами.
3. Володіти технікою зважування на техно-хімічних та аналітичних терезах.
4. Володіти технікою виконання усіх операцій в якісному аналізі речовин.
5. Своєчасно і грамотно оцінити і прочитати результати аналізу сировини.
6. Відповідно з поставленою задачею вибирати найбільш раціональних метод її рішення, спланувати та поставити навчально-дослідний експеримент.
7. Оволодіти технікою хімічних розрахунків.
ЛІТЕРАТУРА
Основна
Хомченко І.Г. Загальна хімія: Підручник: Пер. з рос.К.: Вища шк., 1993.424 с.; ил.
Левітін Є.Я., Бризицька А.М., Клюєва Р.Г.Загальна та неорганічна хімія.Х.: Прапор, Вид-но НФАУ, 2000.
Основы аналитической химии. В 2 кн. Кн.1. Общие вопросы. Методы разделения. Кн.2. Методы химического анализа./Под ред. Ю.А.Золотова.М.: Высшая школа, 2000.
Харитонов Ю.Я. Аналитическая химия (аналитика). В 2 кн-М.: Высшая школа, 2001.
Додаткова
Ахметов Н.С. Общая и неорганическая химия: Учеб. для химико-технол. вузов.2-е изд., перераб. и доп.М.: Высш. шк., 1988.640 с.; ил.
6. Н.Л. Глинка. Общая химия.-Л.: Химия, 1986г.
Васильев В.П. Аналитическая химия. В 2 ч.М.: Высшая школа, 1989.
Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. Т 1, 2.М.: Химия,1990.
9. Цитович И.К. Курс аналитической химии.М.: Высшая школа, 1977.
10. Алексеев В.Н. Курс качественного полумикроанализа.М.: Химия, 1973.
11. Крешков А.П. Основы аналитической химии. В 3 ч.М.: Химия, 1977.
12. Бессероводородные методы качественного полумикроанализа./Под ред. Крешкова А.П.М.: Высшая школа, 1979.
13. Л.Н. Захаров. Техника безопасности в химической лаборатории.-Л.: Химия, 1990г.
Методичні матеріали
Методічні вказівки для самостійної роботи над дисципліною “Хімія та методи дослідження сировини та матеріалів”. Розділ “Загальні основи аналітичної хімії” (фах 7.050301 “Товарознавство і торгівля продовольчими товарами”), 1998, 60 с.
Методичні вказівки до виконання лабораторних робіт з аналізу катіонів при їх розподілі на аналітичні групи за кислотно-лужною класифікацією, 1995 р, 65 с.
Методичні вказівки до самостійної роботи з якісного аналізу “Реакції катіонів IVI аналітичних груп при аналізі їх суміші кислотно-лужним методом. Реакції при аналізі аніонів”. 1998 р., 23 с.
17.Хімія та методи дослідження сировини та матеріалів. Методичні вказівки для самостійної підготовки та виконання лабораторних робіт студентами то-варознавчого факультету, 2002 р.
2 Приклади рішення типових задач. Питання та задачі до контрольних робіт
2.1 Приклади рішення типових задач з теми
“Класи неорганічних сполук”
Приклад 1.Назвіть наступні
хімічні сполуки, катіони та аніони: а)
![]() ,
,
![]() ,
,
![]() ;
б)
;
б)
![]() ,
,
![]() ;
в)
;
в)
![]() ,
,
![]() ;
г)
;
г)
![]() ,
,
![]() ,
,
![]() .
.
Розв’язання:
а) назви оксидів можна побудувати двома способами:
за допомогою числових префіксів:
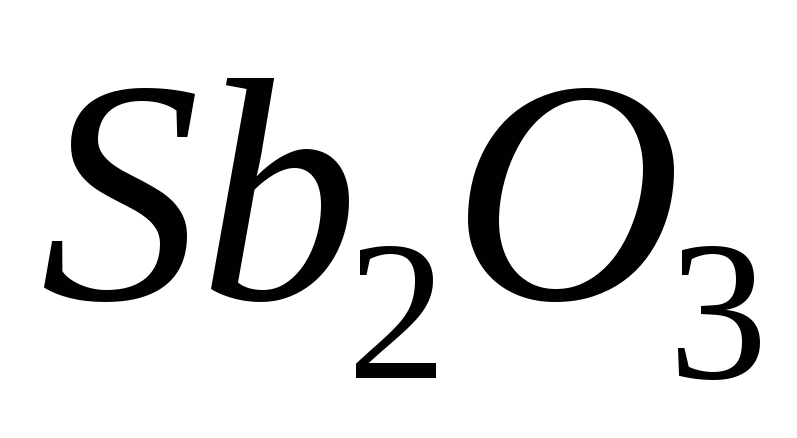 дистибій
триоксид,
дистибій
триоксид,
 діалюміній
триоксид,
діалюміній
триоксид,
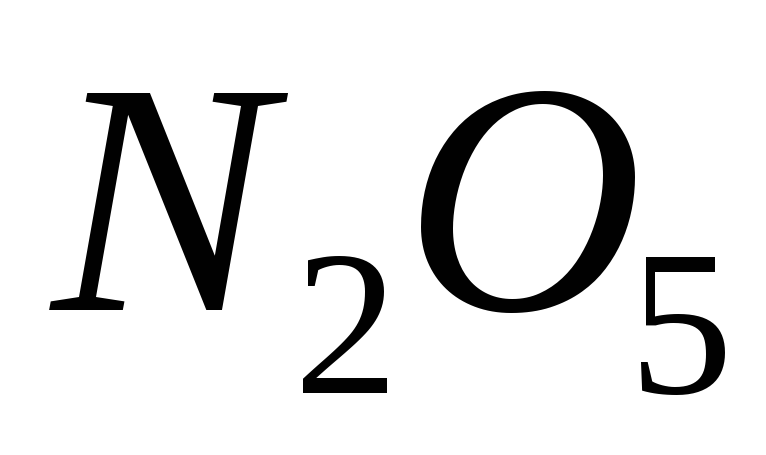 динітроген
пентаоксид;
динітроген
пентаоксид;вказуючи ступінь окиснення елемента у формі катіона:
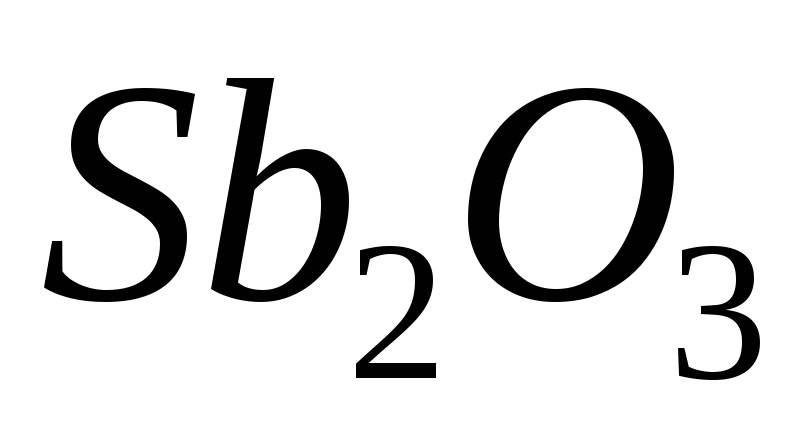 стибій(III)
оксид,
стибій(III)
оксид,
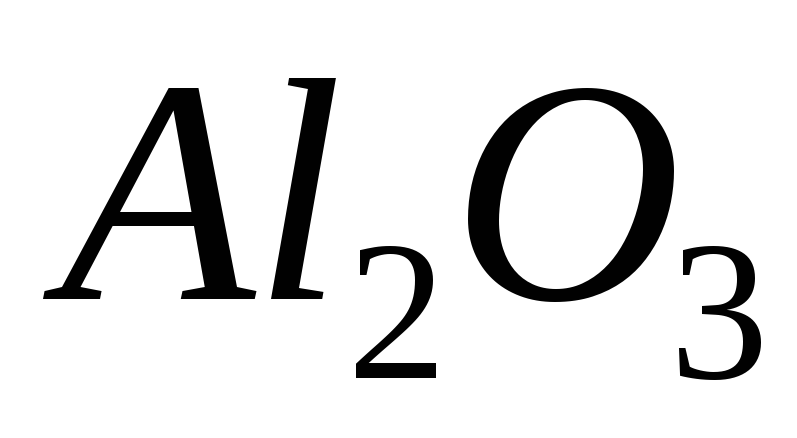 алюміній(III)
оксид,
алюміній(III)
оксид,
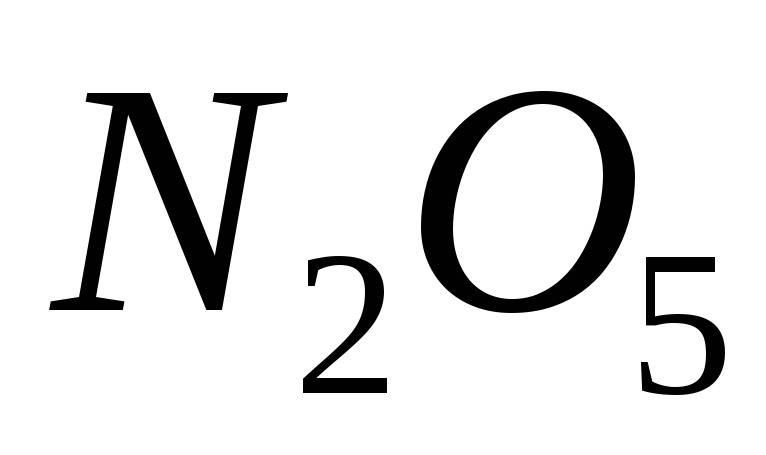 нітроген(V)
оксид;
нітроген(V)
оксид;
б) назви основ та амфотерних гідроксидів можна побудувати двома способами:
називають катіон, додають слово “гідроксид” з відповідним числовим префіксом:
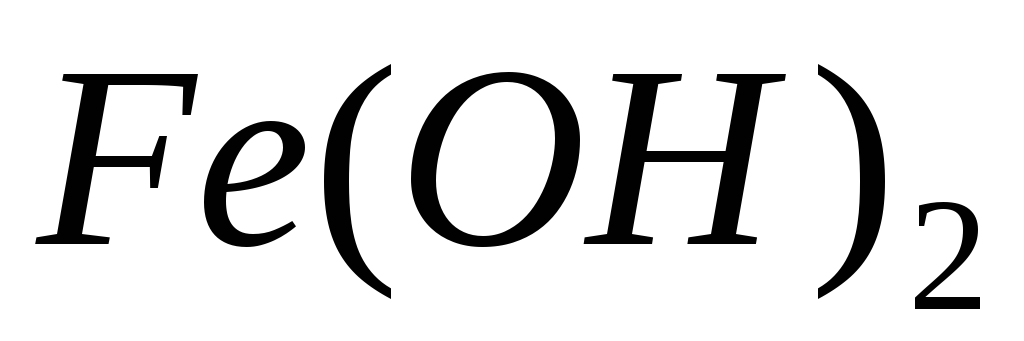 ферум дигідроксид,
ферум дигідроксид,
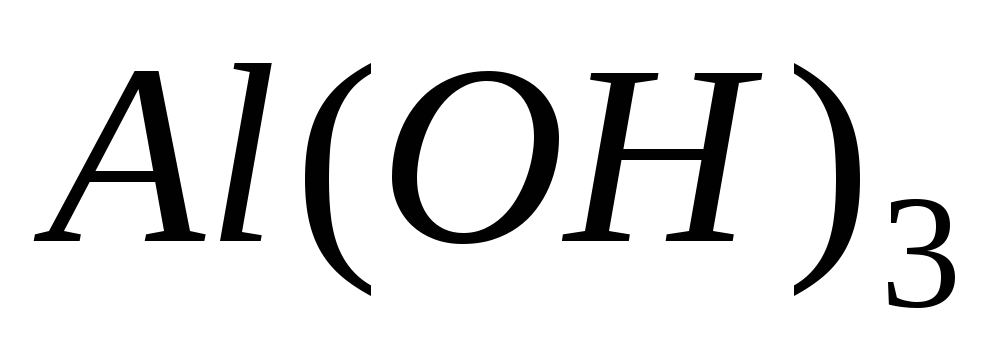 алюміній тригідроксид;
алюміній тригідроксид;називають катіон та додають слово “гідроксид”, вказуючи ступінь окиснення:
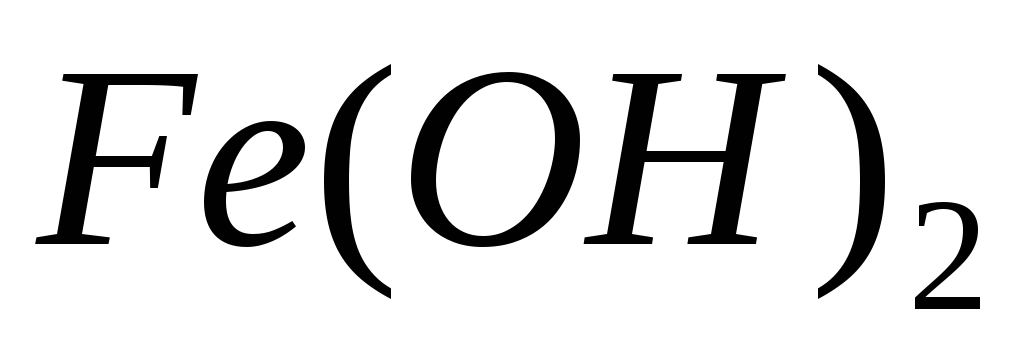 ферум(II)
гідроксид,
ферум(II)
гідроксид,
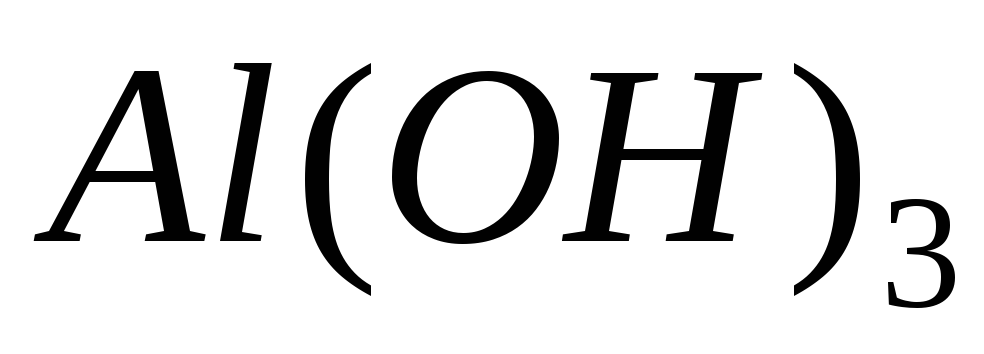 алюміній(III)
гідроксид;
алюміній(III)
гідроксид;
в) оскільки гідроген-катіон вказує на
належність сполуки до кислот, то
систематичну назву можна побудувати,
використовуючи назву аніона замість
прикметника, додаючи до нього іменник
“кислота”:
![]() хлоридна
кислота,
хлоридна
кислота,
![]() сульфатна
кислота.
сульфатна
кислота.
Кислоти, назви яких походять
від аніонів із суфіксом -ід (-ид), називають
як бінарні сполуки гідроген-катіону:
![]() гідроген
хлорид.
гідроген
хлорид.
Можна також зберегти традиційну
назву:
![]() хлороводнева
кислота (хлороводень);
хлороводнева
кислота (хлороводень);
г) одноелементні катіони називають за
елементом, що їх утворив, без зміни назви
останнього, додаванням через дефіс
слова “катіон” і вказівкою на ступінь
окиснення або заряд. Ступінь окиснення
вказують римською, а заряд арабською
цифрою:
![]() хром(II),
хром(II)-катіон, хром(2+)-іон.
хром(II),
хром(II)-катіон, хром(2+)-іон.
Назви одноелементних одноатомних
аніонів складаються з коренів назв
елементів із суфіксом -ид (-ід) та груповою
назвою-іон, що пишеться через дефіс:
![]() іодид-іон,
іодид-іон,
![]() гідроксид-іон.
гідроксид-іон.
Приклад 2. У промисловості барій(II) оксид отримують шляхом нагрівання барій(II) нітрату, при цьому утворюється ще й нітроген(IV) оксид та кисень. Розрахувати, яку кількість барій(II) оксиду можна отримати з 5,2 кг барій(II) нітрату?
Розв’язання: Процес одержання барій(II) оксиду можна відобразити наступним рівнянням:
![]()
Згідно
з цим рівнянням з 1 моль
![]() утворюється 1 моль
утворюється 1 моль
![]() .
.
![]()
де
![]() 137,3+142+166=261,3
137,3+142+166=261,3
![]()
Розрахуємо кількість барій(II)нітрату, що прореагувало:
![]()
![]()
Це
означає, що утворилось 19,9
![]() барій(II)оксиду.
барій(II)оксиду.
![]() ,
,
![]()
![]()
![]()
![]()
![]() =3,05
=3,05
![]()
Відповідь:
![]()
![]()
