
Загальна фізика / Теоретичні курси / Молекулярна фізика та термодинаміка
.pdf
в процесi дроселювання охолоджується ( |
T <0), i негативним, якщо газ нагрiвається |
|
( T >0). |
|
|
Залежно вiд умов дроселювання для одного i того ж газу ефект Джоуля - Томсона |
||
може бути як позитивним, так i негативним. Температура, при якiй (для даного тис- |
||
ку) вiдбувається змiна знаку ефекту Джоуля - Томсона, називається температурою |
||
iнверсiї. Її залежнiсть вiд об’єму отримаємо, прирiвнявши вираз (3.14) нулю: |
|
|
2a |
b |
(3.15) |
T = Rb |
(1 − V ) |
|
Крива, що описується рiвнянням (3.15), - крива iнверсiї приведена на (Рис.3.7). Об- |
||
ласть, що розташована вище кривої вiдповiдає негативному ефекту Джоуля - Томсона, |
||
нижче - позитивному. Вiдзначимо, що при великих перепадах тиску на дроселi темпе- |
||
ратура газу значно змiнюється. Так, при дроселюваннi вiд 20 до 0,1 МПа i початковiй |
||
температурi 17oС, повiтря охолоджується на 35oС. |
|
|
Рис. 3.7. |
Рис. 3.8. |
|

Ефект Джоуля - Томсона обумовлений вiдхиленням газу вiд iдеальностi. Дiйсно, для |
|
молю iдеального газу pVm = RT , тому вираз (3.12) прийме вигляд |
|
|
CV T1 + RT1 = CV T2 + RT2 |
звiдки слiдує, що T1 =T2 |
|
3.6. |
Зрiджування газiв |
Перетворення будь-якого газу в рiдину зрiджування газу можливе лише при |
|
температурi нижче критичної (див. §62). При раннiх спробах зрiджування газiв вияви- |
|
лося, що деякi гази (12, 2, NH3) легко зрiджувалися iзотермiчним стисненням, а цiлий |
|
ряд газiв (2, N2, H2, He) зрiджуванню не пiддавався. Подiбнi невдалi спроби пояснив |
|
Д. I. Менделєєв, який показав, що зрiджування цих газiв проводилося при температурi, |
|
бiльшiй критичної, i тому наперед було приречене на невдачу. Згодом вдалося отрима- |
|
ти рiдкий кисень, азот i водень (їх критичнi температури дорiвнюють вiдповiдно 154,4, |
|
126,1 i 33 К), а в 1908 р. нiдерландський фiзик Г. Камерлiнг-Оннес (1853 1926) добився |
|
зрiджування гелiю, що має найнижчу критичну температуру (5,3 К). Для зрiджування |
|
газiв частiше застосовуються два промисловi методи, в основi яких використовується |
|
або ефект Джоуля Томсона, або охолоджування газу при здiйсненнi ним роботи. |
|
Схема однiєї з установок, в якiй використовується ефект Джоуля - Томсона, - маши- |
|
ни Лiнде 9 - представлена на (Рис.3.8). Повiтря в компресорi (К) стискається до тиску |
|
9К. Лiнде(1842 1934) нiмецький фiзик i iнженер. |
|

в десятки мегапаскаль i охолоджується в холодильнику (X) до температури нижче за |
температуру iнверсiї, внаслiдок чого при подальшому розширеннi газу спостерiгається |
позитивний ефект Джоуля - Томсона (охолоджування газу при його розширеннi). По- |
тiм стисле повiтря проходить по внутрiшнiй трубi теплообмiнника (ТО) i пропускається |
через дросель (Др), при цьому вiн сильно розширяється i охолоджується. Повiтря, що |
розширилося, знов засмоктується по зовнiшнiй трубi теплообмiнника, охолоджуючи дру- |
гу порцiю стислого повiтря, що проходить по внутрiшнiй трубi. |
Оскiльки кожна наступна порцiя повiтря заздалегiдь охолоджується, а потiм про- |
пускається через дросель, то температура знижується все бiльше. В результатi 6 8- |
годинного циклу частина повiтря ( 5% ), охолоджуючись до температури нижче кри- |
тичної, зрiджується i поступає в посудину дьюара (ДС) (див. §49), а решта його частини |
повертається в теплообмiнник. |
Другий метод зрiджування газiв базується на охолоджуваннi газу при здiйсненнi ним |
роботи. Стислий газ, поступаючи в поршневу машину (детандер), розширюється i вико- |
нує при цьому роботу по пересуванню поршня. Оскiльки робота виконується за рахунок |
внутрiшньої енергiї газу, то його температура при цьому знижується. |
Академiк П. Л. Капiца запропонував замiсть детандера застосовувати турбодетан- |
дер, в якому газ, що стиснутий всього лише до 500 600 кПа, охолоджується, виконуючи |
роботу по обертанню турбiни. Цей метод успiшно застосований Капiцею для зрiджуван- |
ня гелiю, попереднє охолоджування якого проводилося рiдким азотом. Сучаснi могутнi |
холодильнi установки працюють за принципом турбодетандера. |

3.7. Властивостi рiдин. Поверхневий натяг |
Рiдина є агрегатним станом речовини, промiжним мiж газоподiбним i твердим, тому |
вона має властивостi як газоподiбних, так i твердих речовин. Рiдини, подiбно твердим |
тiлам, мають певний об’єм, а подiбно газам, приймають форму посудини, в якiй вони |
знаходяться (див. §28). Молекули газу практично не зв’язанi мiж собою силами мiжмо- |
лекулярної взаємодiї, i в даному випадку середня енергiя теплового руху молекул газу |
набагато бiльша середньої потенцiйної енергiї, обумовленої силами притягання мiж ни- |
ми (див. §60), тому молекули газу розлiтаються в рiзнi боки i газ займає наданий йому |
об’єм. В твердих i рiдких тiлах сили притягання мiж молекулами вже iстотнi i утри- |
мують молекули на певнiй вiдстанi один вiд одного. В цьому випадку середня енергiя |
хаотичного (теплового) руху молекул менша середньої потенцiйної енергiї, обумовленої |
силами мiжмолекулярної взаємодiї, i її недостатньо для подолання сил притягання мiж |
молекулами, тому твердi тiла i рiдини мають певний об’єм. |
Рентгеноструктурний аналiз рiдин показав, що характер розташування частинок рi- |
дини промiжний мiж газом i твердим тiлом. В газах молекули рухаються хаотично, тому |
немає нiякої закономiрностi в їх взаємному розташуваннi. Для твердих тiл спостерi- |
гається так званий дальнiй порядок в розташуваннi частинок, тобто їх впорядковане |
розташування, що повторюється на великих вiдстанях. В рiдинах має мiсце так званий |
ближнiй порядок в розташуваннi частинок, тобто їх впорядковане розташування, що |
повторюється на вiдстанях, порiвнянних з мiжатомними. |
Теорiя рiдини до теперiшнього часу повнiстю не розвинута. Розробка ряду проблем |

в дослiдженнi складних властивостей рiдини належить Я. И. Френкелю (1894 1952). |
Тепловий рух в рiдинi вiн пояснював тим, що кожна молекула протягом деякого часу |
коливається бiля певного положення рiвноваги, пiсля чого стрибком переходить в нове |
положення, вiддалене вiд початкового на вiдстанi порядку мiжатомного. Таким чином, |
молекули рiдини досить поволi перемiщаються по всiй масi рiдини i дифузiя вiдбувається |
набагато повiльнiше, нiж в газах. З пiдвищенням температури рiдини частота коливаль- |
ного руху рiзко збiльшується, зростає рухливiсть молекул, що, у свою чергу, є причиною |
зменшення в’язкостi рiдини. |
На кожну молекулу рiдини з боку оточуючих молекул дiють сили притягання, що |
швидко зменшуються з вiдстанню (див. Рис.3.1); отже, починаючи з деякої мiнiмальної |
вiдстанi силами притягання мiж молекулами можна нехтувати. Ця вiдстань (порядку |
10−9 м) називається радiусом молекулярної дiї r, а сфера радiусу r сферою молеку- |
лярної дiї. |
Видiлимо усерединi рiдини яку-небудь молекулу (Рис.3.9) i проведемо навкруги неї |
сферу радiусу r. |
Достатньо, згiдно визначенню, врахувати дiю на дану молекулу тiльки тих молекул, |
якi знаходяться всерединi сфери молекулярної дiї. Сили, з якими цi молекули дiють |
на молекулу , направленi в рiзнi боки i в середньому компенсуються, тому результую- |
ча сила, що дiє на молекулу всерединi рiдини з боку iнших молекул, дорiвнює нулю. |
Iнакше йде справа, якщо молекула, наприклад молекула розташована вiд поверхнi на |
вiдстанi, меншiй r. В даному випадку сфера молекулярної дiї лише частково розташо- |
вана всерединi рiдини. Оскiльки концентрацiя молекул в розташованому над рiдиною |
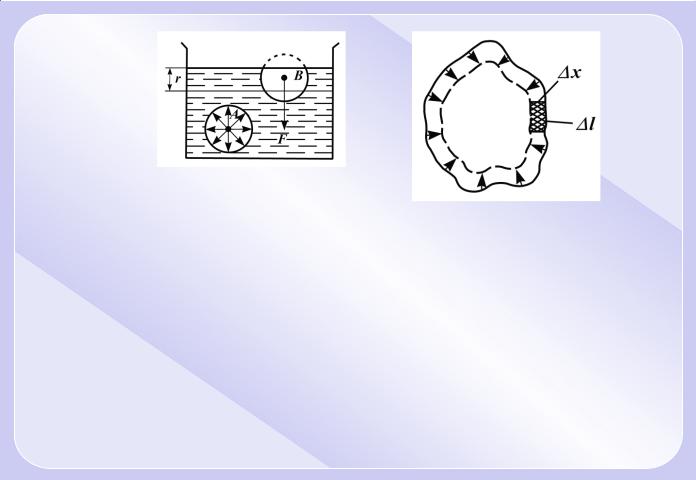
Рис. 3.9. |
Рис. 3.10. |
газi мала в порiвняннi з їх концентрацiєю в рiдинi, то рiвнодiюча сил F , прикладена до |
|
кожної молекули поверхневого шару, не дорiвнює нулю i направлена всередину рiдини. |
|
Таким чином, результуючi сили всiх молекул поверхневого шару чинять на рiдину тиск, |
|
який називається молекулярним (або внутрiшнiм). Молекулярний тиск не дiє на тiло, |
|
помiщене в рiдину, оскiльки вiн обумовлений силами, що дiють тiльки мiж молекулами |
|
самої рiдини. |
|
Сумарна енергiя частинок рiдини складається з енергiї їх хаотичного (теплового) ру- |
|
ху i потенцiйної енергiї, обумовленої силами мiжмолекулярної взаємодiї. Для перемiщен- |
|
ня молекули з глибини рiдини в поверхневий шар треба затрачувати роботу. Ця робота |
|
виконується за рахунок кiнетичної енергiї молекул i йде на збiльшення їх потенцiйної |
|
енергiї. Тому молекули поверхневого шару рiдини володiють бiльшою потенцiйною енер- |
|

гiєю, нiж молекули всерединi рiдини. Ця додаткова енергiя, якою володiють молекули |
|||||
в поверхневому шарi рiдини, називається поверхневою енергiєю, i пропорцiйна площi |
|||||
шару |
S: |
|
|
(3.16) |
|
|
E = σ |
S |
|
||
де σ поверхневий натяг. |
|
|
|
|
|
Оскiльки рiвноважний стан характеризується мiнiмумом потенцiйної енергiї, то рi- |
|||||
дина за вiдсутностi зовнiшнiх сил буде приймати таку форму, щоб при заданому об’ємi |
|||||
вона мала мiнiмальну поверхню, тобто форму кулi. Спостерiгаючи найдрiбнiшi крапель- |
|||||
ки, зваженi в повiтрi, можемо бачити, що вони дiйсно мають форму кульок, але дещо |
|||||
спотворену через дiю сил земного тяжiння. В умовах невагомостi крапля будь-якої рi- |
|||||
дини (незалежно вiд її розмiрiв) має сферичну форму, що доведено експериментально |
|||||
на космiчних кораблях. |
|
|
|
|
|
Отже, умовою стiйкої рiвноваги рiдини є мiнiмум поверхневої енергiї. Це означає, що |
|||||
рiдина при заданому об’ємi повинна мати якнайменшу площу поверхнi, тобто рiдина |
|||||
прагне скоротити площу вiльної поверхнi. В цьому випадку поверхневий шар рiдини |
|||||
можна уподiбнити розтягнутiй пружнiй плiвцi, в якiй дiють сили натягу. |
|
|
|
||
Розглянемо поверхню рiдини (Рис.3.10), обмежену замкнутим контуром. |
|
|
|
||
Пiд дiє сил поверхневого натягу (направленi по дотичнiй до поверхнi рiдини i перпен- |
|||||
дикулярно дiлянцi контуру, на який вони дiють) поверхня рiдини скоротилася i даний |
|||||
контур перемiстився в положення, вiдзначене свiтло-сiрим кольором. Сили, якi дiють з |
|||||
боку видiленої дiлянки на дiлянки, що межують з ним, виконують роботу |
A = f |
l |
x |
||
де f сила поверхневого натягу, яка дiє на одиницю довжини контуру поверхнi рiдини |
|||||

З Рис.3.10 видно, що |
l |
x = |
S тобто |
|
|
|
|
|
A = f |
S |
(3.17) |
Ця робота виконується за рахунок зменшення поверхневої енергiї, тобто |
|
||||
|
|
|
A = |
E |
(3.18) |
З порiвняння виразiв (3.16) (3.18) видно, що |
|
|
|||
|
|
|
σ = f |
|
(3.19) |
тобто поверхневий натяг σ дорiвнює силi поверхневого натягу, що доводиться на одини- |
|||||
цю довжини контуру, який обмежує поверхню. Одиниця поверхневого натягу ньютон |
|||||
на метр (Н/м) або джоуль на квадратний метр (Дж/м2) (див. (3.19) i (3.16)). Бiль- |
|||||
шiсть рiдин при температурi 300 К має поверхневий натяг порядку 10−2 10−1 Н/м. |
|||||
Поверхневий натяг з пiдвищенням температури зменшується, оскiльки збiльшуються |
|||||
середнi вiдстанi мiж молекулами рiдини. |
|
|
|||
Поверхневий натяг iстотним чином залежить вiд домiшок, що є в рiдинах. Речо- |
|||||
вини, що ослабляють поверхневий натяг рiдини, називаються поверхнево-активними. |
|||||
Найбiльш вiдомою поверхнево-активною речовиною по вiдношенню до води є мило. Воно |
|||||
сильно зменшує її поверхневий натяг (приблизно з 7,5 10−2 до 4,5 10−2 Н/м). Поверхнево- |
|||||
активними речовинами, що знижують поверхневий натяг води, є також спирти, ефiри, |
|||||
нафта i iн. |
|
|
|
|
|

Iснують речовини (цукор, сiль), якi збiльшують поверхневий натяг рiдини завдяки |
|
тому, що їх молекули взаємодiють з молекулами рiдини сильнiше, нiж молекули рiдини |
|
мiж собою. Наприклад, якщо посолити мильний розчин, то в поверхневий шар рiдини |
|
виштовхується молекул мила бiльше, нiж в прiснiй водi. В миловарнiй технiцi мило |
|
”висолюється” цим способом з розчину. |
|
3.8. |
Змочування |
З практики вiдомо, що крапля води розтiкається на склi i приймає форму, зображену на |
|
Рис.3.11, тодi як ртуть на тiй же поверхнi перетворюється на дещо сплюснуту краплю |
|
(Рис.3.12). В першому випадку говорять, що рiдина змочує тверду поверхню, в другому |
|
не змочує її. |
|
Змочування залежить вiд характеру сил, що дiють мiж молекулами поверхневих |
|
шарiв сумiжних середовищ. Для змочуючої рiдини сили притягання мiж молекулами |
|
рiдини i твердого тiла бiльшi, нiж мiж молекулами самої рiдини, i рiдина прагне збiль- |
|
шити поверхню межi стикання з твердим тiлом. Для незмочуючої рiдини сили притяган- |
|
ня мiж молекулами рiдини i твердого тiла меншi нiж мiж молекулами рiдини, i рiдина |
|
прагне зменшити поверхню свого дотику з твердим тiлом. До лiнiї межi стикання трьох |
|
середовищ (точка O є її перетин з площиною креслення) прикладено три сили поверхне- |
|
вого натягу, якi направленi по дотичнiй всередину поверхнi стикання вiдповiдних двох |
|
середовищ (Рис.3.11 i Рис.3.12). Цi сили, вiднесенi до одиницi довжини лiнiї стикання, |
|
дорiвнюють вiдповiдним поверхневим натягам σ12, σ13, σ23. Кут θ мiж дотичними до по- |
|

верхнi рiдини i твердого тiла називається крайовим кутом. Умовою рiвноваги краплi |
|
(Рис.3.11) є рiвнiсть нулю суми проекцiй сил поверхневого натягу на напрям дотичної |
|
до поверхнi твердого тiла, тобто |
|
−σ13 + σ12 + σ23 cos θ = 0 |
|
звiдки |
(3.20) |
cos θ = (σ13 − σ12)/σ23 |
|
Рис. 3.11. |
Рис. 3.12. |
З умови (3.20) слiдує, що крайовий кут може бути гострим або тупим залежно вiд |
|
значень σ3 i σ2. Якщо σ3 > σ2 то cosθ>0 i кут θ гострий (Рис.3.11), тобто рiдина змочує |
|
тверду поверхню. Якщо σ3 < σ2, то cosθ<0 i кут θ тупий (Рис.3.12), тобто рiдина не |
|
змочує тверду поверхню. Крайовий кут задовольняє умовi (3.20), якщо |
|
|σ13 − σ12|/σ23 |
(3.21) |
