
Загальна фізика / Теоретичні курси / Молекулярна фізика та термодинаміка
.pdf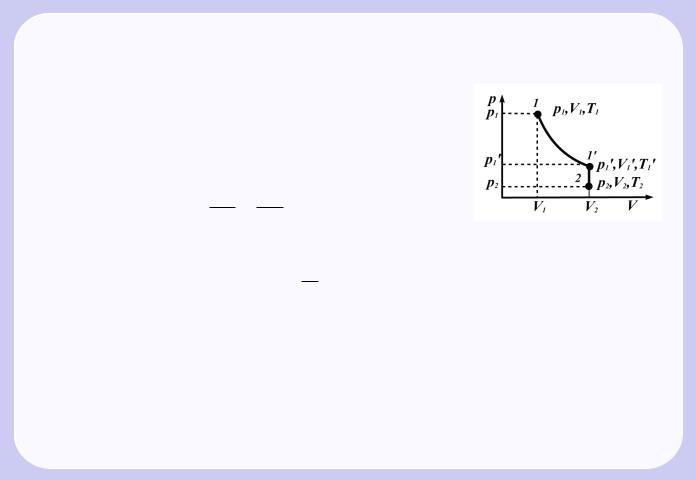
параметрами p2,V2 T2 (Рис.1.4). Перехiд iз стану 1 в стан 2 здiйснюється у виглядi двох процесiв: 1) iзотермiчного (iзотерма 1-1’), 2) iзохорного ( iзохора 1’-2).
Вiдповiдно до законiв Бойля Марiотта (1.6) i Гей-Люссака (1.7) запишемо:
p1/V1 |
= p10 /V2 |
(1.6) |
||||
|
p01 |
= |
T1 |
(1.7) |
||
|
|
|
|
|||
|
p2 |
T2 |
||||
|
|
|
||||
Виключивши з рiвнянь (1.6) i (1.7) 01 отримаємо
p1V1 = p2V2 T1 T2
Оскiльки стани 1 i 2 були вибранi довiльно, то для даної маси газу величина pVT тобто
pV
T
= B = const
Рис. 1.4. залишається сталою,
(1.8)
Вираз (1.8) є рiвнянням Клапейрона, в якому газова стала, рiзна для рiзних газiв.
Росiйський учений Д. И. Менделєєв (1834 1907) об’єднав рiвняння Клапейрона iз законом Авогадро, вiднiсши рiвняння (1.8) до одного моля, використавши молярний об’єм Vm. Згiдно закону Авогадро, при однакових i T моль всiх газiв займає однаковий молярний об’єм Vm, тому стала буде однаковою для всiх газiв. Ця загальна для всiх газiв стала позначається R i називається молярною газовою сталою. Рiвнянню
pVm = RT |
(1.9) |
задовольняє лише iдеальний газ, i воно є рiвнянням стану iдеального газу, яке називається також рiвнянням Клапейрона Менделєєва.

Числове значення молярної газової сталої визначимо з формули (1.9), вважаючи, що моль газу знаходиться за нормальних умов (p0 = 1, 013 · 105Па, T0 = 273, 15, Vm=22,41·103 м3/моль): R=8,31 Дж/(моль К).
Вiд рiвняння (1.9) для молю газу можна перейти до рiвняння Клапейрона Менделєєва для довiльної маси газу. Якщо при деякому заданому тиску i температурi один моль газу займає молярний об’єм Vm, то при тих же умовах маса m газу займе об’єм V = (m/M)Vm , де молярна маса (маса одного моля речовини). Одиниця молярної маси кiлограм на моль (кг/моль). Рiвняння Клапейрона Менделєєва для маси m газу
pV = |
m |
= νRT |
(1.10) |
MRT |
де ν = m/M кiлькiсть речовини.
Часто користуються дещо iншою формою рiвняння стану iдеального газу, вводячи сталу Больц-
мана:
k = R/RNA = 1, 38 · 10−23Дж/К . Виходячи з цього рiвняння стану (1.9) запишемо у виглядi
p = RT/Vm = kNAT /Vm = nkT |
|
де NA/Vm = n концентрацiя молекул (число молекул в одиницi об’єму) |
|
Таким чином, з рiвняння |
|
p = nkT |
(1.11) |
слiдує, що тиск iдеального газу при данiй температурi прямо пропорцiйний концентрацiї його молекул (або густинi газу). При однаковiй температурi i тиску всi гази мiстять в одиницi об’єму oднакове число молекул. Число молекул, що мiстяться в 1 м3 газу за нормальних умов, називаєтьсячислом Лошмiдта

5:
NL = p0/kT0 = 2, 68 · 1025м−3
1.3.Основне рiвняння молекулярно-кiнетичної теорiї iдеальних газiв
Для виведення основного рiвняння молекулярно-кiнетичної теорiї розглянемо одноатомний iдеальний газ. Припустимо, що молекули газу рухаються хаотично, число взаємних зiткнень мiж молекулами газу нескiнченно мале в порiвняннi з числом ударiв об стiнки посудини, а зiткнення молекул iз стiнками посудини абсолютно пружнi. Видiлимо на стiнцi посудини деяку елементарну площадку S (Рис.1.5) i обчислимо тиск, який чинять молекули на цю площадку. При кожному зiткненнi молекула, що рухається перпендикулярно площадцi, передає їй iмпульс moυ − (−moυ) = 2moυ де mo маса молекули υ її швидкiсть. За час t площадку S досягнуть тiльки тi молекули, якi укладенi в об’ємi цилiндра з основою S i висотою υt (Рис.1.5). Число цих молекул n υt (n концентрацiя молекул).
Необхiдно, проте, враховувати, що реально молекули рухаються до площадки S пiд рiзними кутами i мають рiзнi швидкостi, причому швидкiсть молекул при кожному зiткненнi мiняється. Для спрощення розрахункiв хаотичний рух молекул замiнюють рухом уздовж трьох взаємно перпендикулярних напрямiв, так що у будь-який момент часу уздовж кожного з них рухається 1/3 молекул, причому половина молекул 1/6 рухається уздовж даного напряму в одну сторону, половина - в протилежну. Тодi число ударiв молекул, що рухаються в заданому
напрямi, об площадку |
S буде 1/6n υt. При зiткненнi з площадкою |
цi молекули передадуть їй iмпульс |
|
Рис. 1.5. |
|
P = 2m0υ1/ n Sυ t = 1/ nm0υ2 S t |
|
6 |
3 |
5И. Лошмiдт (1821 1895) австрiйський хiмiк i фiзик.

Тодi тиск газу, який вiн чинить на стiнку посудини |
|
p = P / (ΔS t) = 1/ nm0υ2 |
(1.12) |
3 |
|
Якщо газ в об’ємi V мiстить N молекул, що рухаються з швидкостями υ1, υ2, ...υN то доцiльно розглядати середню квадратичну швидкiсть
h i |
uN i=1 |
|
|
||
υsq |
u |
1 |
X |
υi2, |
(1.13) |
= v |
N |
||||
|
t |
|
|
|
|
яка характеризує всю сукупнiсть молекул газу. Рiвняння (1.12) з урахуванням (1.13) прийме вигляд
p = 1/3nm0hυsqi2 |
(1.14) |
Вираз (1.14) називається основним рiвнянням молекулярно-кiнетичної теорiї iдеальних газiв. Точний розрахунок з урахуванням руху молекул по всiх напрямках дає ту ж формулу.
Враховуючи, що n = N/V отримаємо |
|
|
|
pV = 1/3Nm0hυsqi2 |
(1.15) |
||
або |
|
|
|
pV = 2/3N |
m0hυsqi2 |
= 2/3E |
(1.16) |
2 |
|
|
|
де E сумарна кiнетична енергiя поступального руху всiх молекул газу. Оскiльки маса газу m = Nm0, то рiвняння (1.15) можна переписати у виглядi
pV = 1/3mhυsqi2

Для одного моля газу m = M (M молярна маса), тому pVm = 1/3Mhυsqi2
де Vm - молярний об’єм. З iншого боку, з рiвняння Клапейрона-Менделеєва, pVm = RT .
Таким чином
RT = 1/3Mhυsqi2
Звiдки
r
3RT
hυsqi = (1.17)
M
Оскiльки M = m0NA, де m маса однiєї молекули, а NA постiйна Авогадро, то з рiвняння (1.17) слiдує, що
rr
hυsqi = |
3RT |
= |
3kT |
(1.18) |
m0NA |
m0 |
де k = R/NA стала Больцмана. Звiдси знайдемо, що при кiмнатнiй температурi молекули кисню мають середню квадратичну швидкiсть 480 м/с, водню 1900 м/с. При температурi рiдкого гелiю тi ж швидкостi будуть вiдповiдно 40 i 160 м/с.
Середня кiнетична енергiя поступального руху однiєї молекули iдеального газу
ε |
0i |
= E/N = |
m0hυsqi2 |
= 3/ kT |
(1.19) |
h |
2 |
2 |
|||
(використовували формули (1.16) i (1.18)) пропорцiйна термодинамiчнiй температурi i залежить тiльки вiд неї. З цього рiвняння слiдує, що при T =0 <ε>=0, тобто при 0 припиняється поступальний рух молекул газу, а отже, його тиск дорiвнює нулю. Таким чином, термодинамiчна температура є мiрою середньої кiнетичної енергiї поступального руху молекул iдеального газу, i формула (1.19) розкриває молекулярно-кiнетичне тлумачення температури.

1.4.Закон Максвела про розподiл молекул iдеального газу по швидкостях i енергiях теплового руху
При виведеннi основного рiвняння молекулярно-кiнетичної теорiї молекулам задавали рiзнi швидкостi. В результатi багатократних зiткнень швидкiсть кожної молекули змiнюється по модулю i напряму. Проте, через хаотичний рух молекул всi напрями руху є рiвноiмовiрними, тобто в будь-якому напрямi в середньому рухається однакове число молекул.
По молекулярно-кiнетичнiй теорiї, як би не змiнювалися швидкостi молекул при зiткненнях, середня квадратична швидкiсть молекул масою m в газi, що знаходиться в станi рiвноваги при =const,
залишається постiйною i рiвною hυsqi = |
3kT /m0. |
Це пояснюється тим, що в газi, що |
знаходиться в станi рiвноваги, встановлюється деякий стацiо- |
p |
нарний, не змiнний з часом розподiл молекул по швидкостях, який пiдкоряється цiлком певному статистичному закону. Цей закон теоретично виведений Дж. Максвелом.
При виведеннi закону розподiлу молекул по швидкостях Максвел припускав, що газ складається з дуже великого числа N тотожних молекул, що знаходяться в станi хаотичного теплового руху при однаковiй температурi. Припускалось також, що силовi поля на газ не дiють.
Закон Максвела описується деякою функцiєю f(υ), яка називається функцiєю розподiлу молекул по швидкостях. Якщо розбити дiапазон швидкостей молекул на малi iнтервали, рiвнi dυ то на кожний iнтервал швидкостi буде доводитися деяке число молекул dN(υ), що мають швидкiсть, яка знаходиться в цьому iнтервалi. Функцiя f(υ) визначає вiдносне число молекул dN(υ)/N, швидкостi яких лежать в iнтервалi вiд υ до υ + dυ, тобто
dN (υ) /N = f (υ) dυ,
звiдки
f (υ) = dNNdυ(υ) .

Рис. 1.6. |
Рис. 1.7. |
Застосовуючи методи теорiї ймовiрностi, Максвел знайшов функцiю f(υ) закон про розподiл молекул iдеального газу по швидкостях:
f (υ) = 4π |
m0 |
|
3/2 |
|
|
υ2exp −m0υ2/(2kT ) . |
(1.20) |
||||
2πkT |
З (1.20) видно, що конкретний вид функцiї залежить вiд роду газу (вiд маси молекули) i вiд параметра стану (вiд температури T )
Графiк функцiї (1.20) приведений на (Рис.1.6).
Оскiльки, при зростаннi υ множник exp −m0υ2/(2kT ) зменшується швидше, нiж росте множник υ2, то функцiя f(υ), починаючись вiд нуля, досягає максимуму при υB i потiм асимптотично прагне до нуля. Крива несиметрична вiдносно υB.
Вiдносне число молекул dN(υ)/N, швидкостi яких лежать в iнтервалi вiд υ до υ + dυ знаходиться як площа заштрихованої смужки на (Рис.1.6) Площа, обмежена кривою розподiлу i вiссю абсцис, дорiвнює

одиницi. Це означає, що функцiя f(υ) задовольняє умовi нормування
∞
Z
f (υ)dυ = 1.
0
Швидкiсть, при якiй функцiя розподiлу молекул iдеального газу по швидкостях максимальна, називається найбiльш ймовiрною швидкiстю. Значення найбiльш ймовiрною швидкостi можна знайти продиференцiювавши вираз (1.20) (постiйнi множники опускаємо) по аргументу υ, прирiвнявши результат нулю i використовуючи умову для максимуму виразу f(υ):
d |
|
υ2exp −m0 |
υ2/(2kT ) = 2υ 1 − |
m0υ2 |
exp −m0 |
υ2/(2kT ) = 0 |
dυ |
2kT |
|||||
|
|
|
|
|
|
Значення υ=0 i υ = вiдповiдають мiнiмумам виразу (1.20), а значення υ, при якому вираз в дужках стає рiвним нулю, i є найбiльш ймовiрною швидкiсть υB:
p |
|
|
p |
|
|
|
υB = 2kT /m0 = |
2RT /M. |
(1.21) |
||||
З формули (1.21) слiдує, що при пiдвищеннi температури максимум функцiї розподiлу молекул по швидкостях (Рис.1.7) змiститься вправо (значення найбiльш ймовiрної швидкостi стає бiльшим). Проте площа, обмежена кривою, залишається незмiнною, тому при пiдвищеннi температури крива розподiлу молекул по швидкостях буде розтягуватися i знижуватися.
Середня швидкiсть молекули < υ > (середня арифметична швидкiсть) визначається по формулi
∞∞
hυi = N Z |
υdN (υ) = Z |
υf (υ) dυ |
|
1 |
|
|
|
00

Пiдставляючи сюди f(υ) i iнтегруючи, одержуємо
pp
|
|
hυi = 8kT /(πm0) = |
|
8RT /(πM). |
|
|
(1.22) |
||||||||
Швидкостi, що характеризують стан газу: 1) найбiльш ймовiрна υB = |
2RT /(M) |
; 2) середня hυi = |
|||||||||||||
p |
|
|
|
|
|
|
p |
|
|
|
= 1, 22υ |
|
|
||
8RT /(πM) = 1/13υB; 3) середня квадратична hυsqi |
= 3RT /(M) |
B (Рис.1.6). Виходячи з |
|||||||||||||
p |
|
||||||||||||||
розподiлу молекул по швидкостях |
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
dN (υ) = N · 4π |
m0 |
|
3/2 |
2 |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
υ2e−m0υ |
/(2kT)dυ |
|
(1.23) |
|||||||
|
|
2πkT |
|
|
|
||||||||||
можна знайти розподiл молекул газу по значеннях кiнетичної енергiї ε Для цього перейдемо вiд змiнної |
|||||||||||||
υ до змiнної ε = |
m0υ2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
2 |
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2ε/m |
02N |
3/2 |
|
1/2 |
ε/(kT) |
|
|||||
Пiдставивши в (1.23) υ = |
|
|
та dυ = (2m0ε)−1/2 dε отримаємо |
||||||||||
|
|
dN (ε) = |
√ |
|
(kT )− |
|
ε |
e− |
|
dε = Nf (ε) dε, |
|||
|
|
π |
|
|
|||||||||
Де dN(ε) число молекул, що мають кiнетичну енергiю поступального руху в iнтервалi вiд ε ε + dε. Таким чином, функцiя розподiлу молекул по енергiях теплового руху
|
f (ε) = |
|
2 |
|
(kT )3/2 ε1/2e−ε/(kT ). |
||
|
|
|
|
||||
|
|
|
√π |
|
|
||
Середня кiнетична енергiя < ε > молекули iдеального газу |
|||||||
∞ |
εf (ε)dε = |
√π (kT )−3/2 |
∞ |
ε3/2e−ε/kT dε = 3/2kT, |
|||
hεi = Z0 |
Z0 |
||||||
|
|
2 |
|
|
|
|
|
тобто отримали результат, який спiвпадає з формулою (1.19)

1.5.Барометрична формула. Розподiл Больцмана
При виведеннi основного рiвняння молекулярно-кiнетичної теорiї газiв i максвеловського розподiлу молекул по швидкостях припускалось, що на молекули газу зовнiшнi сили не дiють, тому молекули рiвномiрно розподiленi за об’ємом. Проте молекули будь-якого газу знаходяться в потенцiйному полi тяжiння Землi. Тяжiння, з одного боку, i тепловий рух молекул з iншого, приводять до деякого стацiонарного стану газу, при якому тиск газу з висотою зменшується.
Виведемо закон змiни тиску з висотою, припускаючи, що поле тяжiння однорiдне, температура постiйна i маса всiх молекул однакова. Якщо атмосферний тиск на висотi h дорiвнює p, то на висотi h + dh вiн буде дорiвнювати p+dp (при dh>0 dp < 0, оскiльки тиск з висотою зменшується). Рiзниця тиску p i p + dp дорiвнює вазi газу, укладеного в об’ємi цилiндру заввишки dp з площею основи 1м2:
p − (p + dp) = ρgdh
де ρ густина газу на висотi h (dh настiльки мала, що при змiнi висоти в цiй межi густину газу можна вважати постiйною). Отже
dp = −ρgdh |
(1.24) |
Скориставшись рiвнянням стану iдеального газу pV = (m/M)RT (mмаса газу, M молярна маса газу), знаходимо, що
Рис. 1.8.
ρ = mV = (pMRT )
