
- •1.2.Общие вопросы теории химического строения и реакционной способности органических соединений
- •1S22s22p2 или 1s22s22pх 2p y
- •2S 2Px 2Py 2Pz
- •2S 2Px 2Py 2Pz
- •Тема 2. Предельные углеводороды
- •2.3. Физические свойства предельных углеводородов
- •2.4. Химические свойства предельных углеводородов
- •2.5. Получение предельных углеводородов
- •Тема 3. Этиленовые углеводороды
- •3.1. Состояние углерода в этиленовых углеводородах, природа двойной связи
- •3.2. Изомерия, номенклатура углеводородов ряда этилена
- •3.4. Физические свойства
- •3.5. Химические свойства
- •Тема 4. Ацетиленовые углеводороды
- •4.1. Номенклатура углеводородов ряда ацетилена
- •4.2. Физические свойства ацетиленовых углеводородов
- •4.3. Способы получения
- •4.4. Химические свойства
- •Тема 5. Механизм реакций органических соединений
- •5.1. Гомолитическое и гетеролитическое расщепления
- •5.2. Факторы, определяющие реакционную способность молекулы
- •5.3. Классификация органических соединений
- •Тема 6. Ароматические углеводороды
- •6.1. Строение ароматических углеводородов
- •6.2. Номенклатура и изомерия
- •6.3. Способы получения
- •6.4. Химические свойства
- •6.5. Химические свойства гомологов бензола
- •Тема 7. Спирты
- •7.1. Номенклатура и изомерия спиртов
- •7.2. Физические свойства спиртов
- •7.3. Способы получения
- •7.4. Химические свойства
- •7.5. Многоатомные спирты
- •Тема 8. Фенолы
- •8.1. Номенклатура фенолов
- •8.2. Физические свойства
- •8.3. Способы получения
- •8.4. Химические свойства
- •Тема 9. Альдегиды. Кетоны
- •9.1. Номенклатура и изомерия
- •9.2. Способы получения
- •9.3. Физические свойства
- •9.4. Химические свойства
- •Тема 10. Органические кислоты. Амиды
- •10.1. Классификация карбоновых кислот
- •10.2. Номенклатура и изомерия
- •10.3. Способы получения
- •10.4. Физические свойства
- •10.5. Строение
- •10.6. Химические свойства
- •10.7. Амиды
- •Тема 11. Сложные эфиры
- •11.1. Номенклатура и изомерия
- •11.2. Физические свойства сложных эфиров
- •11.3. Химические свойства сложных эфиров
- •Тема 12. Жиры
- •12.1. Номенклатура и изомерия
- •12.2. Физические свойства
- •12.3. Химические свойства
- •Тема 13. Азотсодержащие органические соединения
- •13.1. Нитросоединения
- •13.2. Азотсодержащие гетероциклические соединения
- •13.3. Шестичленные гетероциклы
- •13.4. Соединения с пятичленным циклом
- •13.5. Нуклеиновые кислоты
- •13.6. Амины
- •13.7. Аминокислоты
- •13.8. Белки
- •Тема 14. Углеводы
- •14.1. Номенклатура
- •14.2. Моносахариды
- •14.3. Олигосахариды
- •14.4. Полисахариды
3.4. Физические свойства
Первые четыре члена гомологического ряда этиленовых углеводородов – газы. Олефины с числом углеродных атомов от 5 до 17 – жидкости. Далее идут твердые тела.
Олефины с нормальной цепью углеродных атомов кипят при более высокой температуре, чем их изомеры с разветвленной цепью. Перемещение двойной связи в центр молекулы вызывает повышение температуры кипения. Цис-изомеры обычно кипят при более высокой температуре, чем транс-изомеры.
Перемещение двойной связи в центр молекулы повышает температуру плавления. Транс-изомеры плавятся при более высокой температуре, чем цис-изомеры.
Плотности олефинов меньше единицы, но больше, чем соответствующих парафинов. В гомологическом ряду они увеличиваются. Для олефинов характерны более высокие показатели преломления света, чем для парафинов.
Растворимость олефинов в воде весьма мала, но больше, чем парафинов. Следует заметить, что олефины хорошо растворяются в растворах некоторых солей тяжелых металлов, образуя с ними комплексные соединения (например, в растворах Сu2С12).
3.5. Химические свойства
Главным структурным элементом, определяющим реакционную способность олефинов, является двойная связь, представляющая собой сочетание σ- π-связей. Поскольку σ-связь более прочна, чем π-связь, эта последняя легко переходит в σ -связи путем присоединения по месту двойной связи двух атомов пли атомных групп. Скорость такого присоединения определяется характером присоединяющейся молекулы и характером заместителей у двойной связи.
Таким образом, для олефинов наиболее типичны реакции присоединения. Однако следует иметь в виду, что олефины способны и к реакциям замещения, причем некоторые из них идут значительно легче, чем у парафинов.
В реакциях присоединения двойная связь обычно выступает как донор электронов. Поэтому для олефинов характерна реакция электрофилыюго присоединения (Ае ).
1.Гидрирование. Олефины присоединяют водород в присутствии катализаторов (Pd, Pt, Ni). Например:
![]()
Без катализаторов молекулярный водород или водород в момент выделения они не присоединяют.
Поскольку для гидрирования необходима адсорбция молекулы олефина на катализаторе по двойной связи, олефины гидрируются тем легче, чем меньше заместителей имеется у двойной связи (правило С. В. Лебедева).
Галогенирование. Олефины легко присоединяют галогены:
![]()
Скорость реакции зависит от природы галогена и строения олефина. Фтор реагирует с воспламенением, иод – медленно на солнечном свету. Реакция присоединения облегчается при увеличении числа заместителей у двойной связи. Это объясняют большей поляризацией этиленовой связи под влиянием замещающих радикалов и увеличением устойчивости промежуточных радикалов или ионов благодаря сверхсопряжению.
Галогены могут присоединяться к олефинам по радикальному или ионному механизму.
![]()
Чаще происходит присоединение по ионному электрофильному механизму. Молекула галогена атакует двойную связь, захватывая электроны и образуя так называемый π-комплекс. Затем отделяется отрицательный ион галогена. К возникшему карбониевому катиону присоединяется отрицательный ион галогена:

Реакция олефинов с галогенами служит для качественного и количественного определения их в смесях. По количеству поглощенного брома можно установить содержание олефина.
Гидрогалогенирование. Олефины присоединяют галогеноводороды:
![]()
Присоединение галогеноводородов к несимметричным олефинам происходит в соответствии с правилом В.В. Марковникова: водород направляется преимущественно к наиболее гидрогенизированному углеродному атому:

Такое направление преимущественного присоединения галогено-водорода объясняется тем, что радикалы при углеродных атомах, связанных двойной связью, обладают способностью отталкивать от себя электронное облако (индукционный эффект показан прямой стрелкой, эффект сверхсопряжения – изогнутой), благодаря чему электроны двойной связи смещаются к конечному углеродному атому и он становится более электроотрицательным, способным более активно по сравнению со вторым атомом притягивать протон галогеноводорода. Кроме того, имеет значение стабильность образующихся на первой стадии реакции катионов: катион А более стабилен, чем катион Б, так как в нем более выражено сверхсопряжение (свободная орбита катиона А может взаимодействовать с электронами шести СН-связей, о то время как в катионе Б только с двумя СН-связями):

На второй стадии реакции оба катиона присоединяют анион галогена:

Правило Марковникова соблюдается только при ионном (гетеролитическом) механизме присоединения галогеноводородов. Если имеет место радикальный (гемолитический) механизм, то присоединение галогеноводорода происходит в обратном порядке (перекисный эффект Караша).
Радикальное присоединение наблюдается, например, при действии на олефины бромистого водорода в присутствии перекисей (или кислорода). Последние взаимодействуют с бромистым водородом и освобождают атомы брома, которые и присоединяются по месту двойной связи к крайнему углеродному атому, так как при этом образуется
более стабильный радикал.
Возникающий радикал продолжает реакционную цепь:

Гидратация. В присутствии катализаторов олефины присоединяют воду, образуя спирты. Для получения спиртов часто используется поглощение олефинов концентрированной серной кислотой:

Олефины поглощаются серной кислотой тем легче, чем большее количество радикалов имеется у двойной связи (чем полярнее двойная связь). В настоящее время в технике олефины гидратируются фосфорной кислотой на носителе.
6. Окисление. Олефины окисляются кислородом воздуха или другими окислителями. Направление окисления зависит от условий реакции и выбора окислителя:
а) олефины с кислородом воздуха без катализаторов образуют гидроперекиси, распадающиеся с образованием спиртов и карбонильных соединений. Воздействию кислорода подвергается обычно наиболее подвижный водородный атом с разрывом β-связи по отношению к двойной:

б) кислородом воздуха в присутствии серебряного катализатора олефины окисляются до органических окисей:

Аналогично действуют гидроперекиси ацилов:

в) разбавленный раствор перманганата калия (реакция Вагнера) или перекись водорода в присутствии катализаторов (CrO3, OsO4 и др.) с олефинами образуют гликоля. По месту двойной связи происходит присоединение двух гидроксилов:

г) при действии концентрированных растворов окислителей (перманганат калия, хромовая кислота, азотная кислота) происходит разрыв молекулы олефина по месту двойной связи с образованием кетонов и кислот:

Эта реакция широко используется для определения строения олефинов, так как по образовавшимся кислотам и кетонам можно сделать заключение о строении и составе радикалов, связанных с двойной связью в исходном соединении.
7. Алкилирование. Особое место среди реакций присоединения олефинов занимают процессы, идущие с удлинением углеродной цепи. К таким процессам относится, например, алкилирование олефинов парафинами в присутствии фосфорной или серной кислот:


Этим путем можно получать парафины с изостроением, например изооктан, представляющие большой интерес как высокооктановое моторное топливо.
8. Полимеризация. Одним из наиболее важных для современной техники превращений олефинов является реакция их полимеризации, открытая А.М. Бутлеровым. Полимеризацией называют процесс образования высокомолекулярного вещества (полимера) путем соединения друг с другом с помощью главных валентностей молекул исходного низкомолекулярного вещества (мономера).
Полимеризация олефинов может быть вызвана нагреванием, сверхвысоким давлением, облучением, действием свободных радикалов или катализаторов. В реакцию полимеризации могут вступать как индивидуальные вещества, так и смеси мономеров. В последнем случае говорят о смешанной полимеризации (сополимеризации).
Склонность к полимеризации зависит от строения олефинов: обычно замещение водорода на радикалы по обоим концам двойной связи мешает полимеризации (пространственные трудности).
Полимеризация олефинов в зависимости от механизма может быть двух видов: 1) радикальная, или инициированная, 2) ионная, или каталитическая.
Радикальная полимеризация вызывается (инициируется) веществами, способными в условиях реакции распадаться на свободные радикалы (перекиси, диазоаминосоединения и другие вещества), а также действием тепла и света. Растущая частица полимера вплоть до момента стабилизации представляет собой свободный радикал. Радикалы-инициаторы входят в состав молекулы полимера, образуя его конечную группу:
![]()
Обрыв цепи происходит при столкновении либо с молекулой регулятора роста цепи (которым может быть специально добавленное вещество, легко отдающее атом водорода или галогена), либо с молекулой мономера.
Каталитическая, или ионная (катионная и анионная), полимеризация происходит благодаря образованию из молекул мономера реакционноспособных ионов.
Катализаторами катионной полимеризации являются кислоты, безводные хлориды алюминия, бора и т. д. При каталитической полимеризации катализатор обычно регенерируется и не входит в состав полимера. Процесс также может иметь цепной характер и протекать с очень большой скоростью. Поэтому ионную полимеризацию проводят при очень низких температурах.
Механизм катионной полимеризации этилена в присутствии АlСl3 можно представить следующим образом:
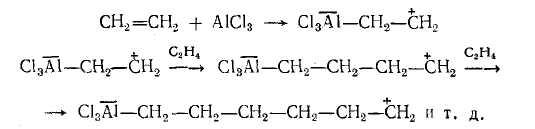
На каждой стадии может произойти освобождение катализатора, например, по схеме
![]()
Катализаторы анионной полимеризации – щелочные металлы, металлорганические соединения, амиды щелочных металлов и т. д.
Механизм анионной полимеризации под влиянием металлалкилов можно представить следующим образом:

Интерес к этому виду полимеризации обусловлен успешным его применением для получения полиэтилена низкого давления (в присутствии R2A1C1 и TiCl3).
На реакцию полимеризации сильное влияние оказывает наличие в мономере ничтожных примесей. Некоторые примеси, например многоатомные фенолы, ароматические амины, хиноны, способны задерживать полимеризацию. Такие вещества называются ингибиторами (замедлителями). Ингибиторами пользуются при хранении мономеров.
В результате полимеризации могут получаться жидкие вещества различной консистенции или твердые вещества. Многие из них находят широкое применение в технике. Изменением условий полимеризации и полимеризацией смесей различных веществ можно получать продукты с заданными свойствами.
Полимеры, содержащие асимметричные атомы углерода, могут быть пространственно упорядоченными (стереорегулярными) синдиотактшескими (А) и изотактическими (Б) или неупорядоченными (атактическими):

Как видно из формул, различия между этими полимерами связаны с расположением заместителей по отношению к главной цепи. Конфигурация полимеров в значительной степени определяет их практически ценные свойства.
Изомеризация. При высоких температурах или в присутствии катализаторов олефины способны изомеризоваться. При этом происходит или перемещение двойной связи (обычно в центр молекулы), или изменение строения углеродного скелета, или же то и другое одновременно:

