- •Изоляторы: кислотные и основные катализаторы.
- •Кислотные катализаторы.
- •Основные катализаторы
- •Взаимодействие активного компонента с носителем и промоторами.
- •Нанесенные катализаторы.
- •Дисперсность нанесенных металлов.
- •Процессы миграции металлов по поверхности.
- •Электронное взаимодействие металл-носитель.
- •Сильное взаимодействие металл-носитель (свмн)
- •Бифункциональные катализаторы.
- •Ситовой эффект.
- •Промоторы.
- •Дезактивация и регенерация катализаторов.
- •Отравление катализатора
- •Отравление металлов.
- •Отравление полупроводниковых оксидных катализаторов.
- •Отравление кислотно-основных катализаторов.
- •Промотирующее отравление катализаторов.
- •Отложения на поверхности катализатора
- •Причины и механизмы отложений.
- •Способы предотвращения и удаления отложений.
- •Источники каталитических ядов и ингибиторов.
- •Термически инициируемые процессы.
- •Фазовые превращения.
- •Спекание.
- •Унос катализатора газовой (жидкой) фазой
- •Обратимая и необратимая дезактивация. Способы регенерации катализаторов.
- •Кинетика дезактивации
-
Основные катализаторы
Твердые основные катализаторы, в отличии от кислотных, используются лишь в не большом количестве промышленных процессов. По химическому строению твердые основные катализаторы представляют собой, в основном, смесь оксидов щелочноземельных и щелочных металлов.
Оксиды щелочноземельных металлов.
Наиболее изученным катализатором является MgO. На его поверхности протонодонорные вещества (НХ = вода, спирты, карбоновые кислоты, ацетиленовые углеводороды и т.д.) подвергаются диссоциативной гетеролитической хемосорбции:
 (5.79)
(5.79)
В результате прокаливания при высокой температуре основность MgO сильно возрастает вследствии глубокого дегидроксилирования поверхности. В таком активированном состоянии оксид магния способен депротонировать даже такие слабые кислоты Бренстеда, как NН3 (рКа = 36) и пропилен (рКа = 35). Более того, была даже зафиксирована реакция гетеролитического распада Н2 на поверхности MgO.
Щелочные металлы.
Еще один тип гетерогенных основных катализаторов - это щелочные металлы и их гидроокиси, нанесенные на пористый носитель (чаще всего Al2O3).
Гидротальцитоподобные материалы.
Третий тип твердых основных катализаторов - гидротальцито-подобные материалы. Это твердые вещества, имеющие структуру, подобную гидротальцитам. Гидротальцит - это природная глина с химическим составом, описываемым формулой:
Mg6Al2(OH)164(H2O)
Структура гидротальцитоподобных материалов (Рис.5.51) сформирована из брусито-подобных слоев Mg(OH)2, в которых часть катионов Mg2+, замещена на Al3+. Избыточный положительный заряд алюминия компенсируется анионами СО32-, находящимися в межслойном пространстве. Там же находятся молекулы воды. Анионы СО32- можно обменивать на другие анионы, изменяя таким образом основные свойства гидротальцита.
Кроме того гидротальциты можно синтезировать из катионов металлов (М2+/М3+), отличных от Mg2+ и Al3+, что также позволяет менять каталитические свойства этих материалов.

Рис. 5.51. Структура гидротальцита.
Изомеризация олефинов.
Прокаленный при 700-900оС СаО является еще более сильным основанием, чем MgO. На обоих катализаторах активно протекает реакция изомеризации (миграции) двойной связи в олефинах. Например бутен-1 изомеризуется в бутен-2 благодаря образованию на поверхности катализатора промежуточного метилаллил-аниона в результате отрыва основными центрами катализатора протона в аллильном положении:
 (5.80)
(5.80)
Наибольшей активностью в основно-каталитических реакциях обладают щелочные металлы нанесенные на Al2O3. Так 5%Na/Al2O3 приводит к полной конверсии 1-бутена в 2-бутен при 20оС. На таком катализаторе легко изомеризуются и высшие -олефины.
Дегидрирование спиртов до карбонильных соединений.
Благодаря легкости депротонирования спиртов (5.79) с образованием поверхностных алкоголятов (R-O-) оксид магния является хорошим катализатором дегидрирования спиртов до карбонильных соединений. Причем добавление к MgO небольших количеств ионов Со2+ (в качестве промотора) увеличивает селективность в этой реакции.
Дегидрогалогенирование.
Оксиды щелочноземельных металлов хорошо катализируют реакцию дегидрогалогенирования галогеналкилов при температуре 100-200оС. Реакция протекает по механизму Е2:
 (5.81)
(5.81)
В этой реакции обнаружен следующий ряд активности катализаторов: SrO >> CaO > MgO > Al2O3 - который точно отражает уменьшение основности оксидов.
Реакция Тищенко.
Термически активированный ВаО катализирует реакцию Тищенко (которая в гомогенной среде катализируется алкоголятами алюминия):
 (5.82)
(5.82)
Механизм катализа изображен на Схеме 5.83. Суть механизма заключается в образовании на поверхности катализатора комплекса (IV) из двух хемосорбированных молекул исходного альдегида (I) и (II). Комплекс обеспечивает каталитический цикл, приводящий к образованию продукта (V).
(5.83)

Применение основных гетерогенных катализаторов в промышленных процессах.
Несмотря на многочисленные исследования гетерогенных основных катализаторов, в промышленности реализовано ограниченное количество процессов. Некоторые из них приведены в Таблице 5.25.
Таблице 5.25.
Примеры промышленных процессов с применением гетерогенных основных катализаторов.
|
Тип процесса |
Реакция |
Катализатор |
|
Алкилирование |
|
|
|
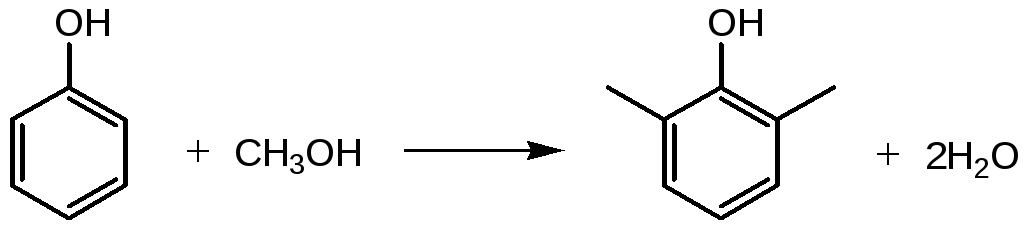
1. Региоселективное алкилирование фенола |
|
MgO |
|
2. Алкилирование в боковую цепь ароматических углеводородов. |
|
Na/K2CO3; K/CaO |
|
3. То же. |
|
Na/KOH/Al2O3 |
|
4. Получение меркаптанов. |
н-Спирты + H2S меркаптаны + Н2О |
Щелочь/Al2O3 |
|
Изомеризация |
|
|
|
5. Миграция двойной связи. |
|
Na/NaOH/Al2O3 |
|
6. Изомеризация аллена в метилацетилен. |
|
K2O/Al2O3 |
|
Дегидратация и конденсация. |
|
|
|
7.
|
|
KOH/ZrO2 |
|
8. Реакция Тищенко |
Уравнение (5.82)-(5.83) |
ВаО; СаО |
|
Полиоксиалкилирование. |
|
|
|
9. Полиоксиэтилирование. |
|
Гидротальцит |
|
Гидрирование |
|
|
|
10. Гидрирование ароматических карбоновых кислот до альдегидов. |
|
ZrO2-Cr2O3 |