
- •Общая неорганическая химия.
- •3. Железо и его соединения. Биологическая роль.
- •4. Ионное произведение воды. Водородный показатель.
- •5. Силы Ван-дер-Ваальса.
- •6. Алюминий и его соединения.
- •7. Упругость пара над раствором. Законы Рауля.
- •8. Хром и его соединения. Биологическая роль.
- •9. Ионная связь.
- •10. Бор и его соединения. Биологическая роль.
- •11. Кислородосодержащие кислоты хлора. Соли этих кислот. Биологическая роль.
- •12. Координационная теория Вернера.
- •13. Классификация и изомерия комплексных соединений.
- •14. Щелочные металлы. Биологическая роль.
- •15. Кислородосодержащие кислоты серы. Соли этих кислот.
- •16. Понятие о квантовой механике.
- •17. Многоэлектонные атомы и периодический закон.
- •18. Окисли азота.
- •19. Окислительно-восстановительные реакции.
- •20. Аммиак и его свойства.
- •21. Водородные соединения галогенов. 22. Галогеноводородные кислоты.
- •23. Метод молекулярных орбиталей.
- •24. Теория электролитической диссоциации.
- •25. Константа и степень электролитической диссоциации.
- •26. Азотная кислота и ее соли.
- •27. Гибридизация атомных орбиталей.
- •28. Фосфор и его свойства.
- •29. Периодичность изменения свойств элементов и их соединений.
- •30. Гидролиз.
- •31. Метод валентных связей.
- •32. Благородные газы.
- •33. Термохимические законы.
- •34. Кислород, его физические и химические свойства. Биологическая роль.
- •35. Металлическая связь.
- •36. Хлор и его свойства. Биологическая роль.
- •37. Водород, вода, их физические и химические свойства. Применение в медицине. Биологическая роль.
- •38. Современная химическая атомистика.
- •39. Осмос. Осмотическое давление. Закон Вант Гоффа.
- •40. Сера, ее физические и химические свойства. Биологическая роль.
- •41. Теория Бора.
- •42. Кремний и его соединения. Биологическая роль.
- •43. Скорость химических реакций. Химическое равновесие.
- •44. Понятие об активном комплексе и энергии активации.
- •45. Серная кислота. Соли серной кислоты.
- •46. Растворы. Растворимость как физико-химический прочес (гидратная теория, теория Менделеева).
- •47. Мышьяк и его соединения. Биологическая роль.
29. Периодичность изменения свойств элементов и их соединений.
В настоящее время Периодический закон Д. И. Менделеева имеет следующую формулировку: «свойства химических элементов, а также формы и свойства образуемых ими простых веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов».
1. Атомный радиус (нм).
Орбитальный атомный радиус – расстояние от центра ядра атома до максимально наиболее удаленной электронной плотности. По периоду: величины атомных радиусов элементов периодически уменьшаются (за счет усиливающегося электростатического напряжения е к ядру, растет кол-во е и притяжение их к ядру); в малых периодах уменьшение атомных радиусов идет быстрее, чем в больших, поскольку d-сжатие.
Лантанидное сжатие.
В короткой периодной системе в одной клетке с лантаном (57) помещаются элементы с общим названием лантаноиды, т.к. схожее строение (d1 s2). 4f2-14 5d0-1 6s2
От центра до лютеция радиусы уменьшаются. Это связано с тем, что идет заполнение электронами с ростом заряда ядра глубоко лежащего 4f подуровня – явление лантанидного сжатия. Лантанидное сжатие оказывает существенное влияние на свойства стоящих за лантанидами в природе, начиная с лафния, элементов.
По группам: атомные радиусы в целом увеличиваются (особенно в главных подгруппах). В побочных изменение радиуса по группе несколько иное. Оно связано с лантанидным сжатием. От титана к цирконию по группе увеличивается, а от циркония к гафнию практически не изменяется. Это связано с тем, что эффект лантанидного сжатия сказывается на уменьшении радиуса стоящих за ними в периоде, начиная с гафния, элементов.
2. Энергия ионизации (I, кДж/моль).
Энергия ионизации – это та энергия, которую необходимо затратить для отрыва от атома наиболее слабо связанного с ним электрона; - ее столько у атома, сколько у него электронов (I1, I2, I3 … In).
По периоду: величины I периодически увеличиваются. Это связано с уменьшением радиуса, увеличением притяжения электронов к ядру.
По группам: уменьшается.
3. Энергия электронного сродства (Еср , кДж/моль)
Обычно говорят об электронном сродстве первого порядка. Энергия электронного сродства – это та энергия, которая выделяется при присоединении к атому одного электрона (экзотермический процесс). Электронное сродство 2-го порядка – величина отрицательная, т.е. присоединени 2-го электрона связано с затратой энергии.
Чем больше энергия сродства, тем сильнее неметалические свойства; тем легче атомы присоединяют электроны.
По периоду: энергия электронного сродства периодически увеличивается.
По группам: уменьшается.
4. Электроотрицательность.
ЭО – способность атомов притягивать к себе электроны (
По периоду: ЭО элементов периодически увеличивается; устойчивость водородных соединений элементов периодически возрастает; металлические свойства элемента периодически уменьшаются; кислотные свойства периодически возрастают, основные – уменьшаются.
30. Гидролиз.
Реакции гидролиза – реакции обменного взаимодействия ионов соли (и др. в-в) с ионами малодиссоциирующих молекул воды. Обратная реакции нейтрализации.
В зависимости от природы соли гидролиз протекает по разному. Рассмотрим реакцию гидролиза соли, образованной слабой кислотой и сильной щелочью.
I. CH3COONa+HOH↔CH3COOH+NaOH
CH3COO-+Na++HOO↔CH3COOH+Na++OH-
CH3COO-+HOH↔CH3COOH+OH-
II. 1)SnCl2+HOH↔SnOHCl+HCl
Sn+2+2Cl-+HOH↔SnOH++Cl-+H++Cl-
Sn+2+HOH↔SnOH++H+
2) SnOHCl+HOH↔Sn(OH)2+HCl
Солью слабой кислоты и слабым основанием:
CH3COONH4: 1. CH3COOH; 2. NH3H2O (=NH4OH) =NH4++OH- - гидрат аммиака
CH3COONH4+HOH→CH3COOH+NH3 ∙ H2O
CH3COO-+NH4++H2O→CH3COOH+NH3 ∙ H2O
Среда близкая к нейтральной, но щелочная.
Факторы, влияющие на гидролиз.
Усиливает гидролиз; 1. Температура – при нагревании процесс идет быстрее;
2. разбавление раствора (концентрация).
Ослабление:
1. Понижение температуры
2. Добавление в раствор или ионов Н+ или ионов ОН-.
Обратная реакции нейтрализации (взаимодействие соли с водой с образованием – в простейшем случае – кислоты и основания) называется реакцией гидролиза соли. Реакция нейтрализации будет обратимой и при взаимодействии сильной кислоты со слабым основанием: HCl+NH4OH=NH4Cl+H2O, а также при взаимодействии слабой кислоты и слабого основания:HAc+NH4OH=NH4Ac+H2O.
Наиболее общим случаем реакций нейтрализации является взаимодействие кислот и оснований, различающихся по силе, когда реакция не доходит до конца в силу протекания обратной реакции – гидролиза образующейся соли. Если соль образована сильной кислотой и сильным основанием (HCl+KOH=KCl+H2O), гидролиз ее не протекает, так как в системе присутствуют три сильных электролита и лишь один слабый – вода. Поэтому, согласно принципу смещения равновесия, применительно к ионным реакциям в растворе это равновесие целиком смещено вправо. В реакциях (HAc+KOH=H2O+KAc;HCl+NH4OH=NH4Cl+H2O;HAc+NH4OH=NH4Ac+H2O) гидролиз протекает в заметной степени и реакция нейтрализации обратима, поскольку слабые электролиты присутствуют и в левой и в правой частях уравнения реакции. Таким образом, причина гидролиза заключается не только в участии в реакции слабой кислоты или основания, но и в диссоциации самой воды. Сущность гидролиза с этой точки зрения состоит в том, что катион соли (слабое основание) либо ее анион (слабая кислота) преимущественно связывает соответственно ионыOH-или Н+с образованием слабого электролита (соответственно основания или кислоты).
Рассмотрим гидролиз соли, образованной сильным основанием и слабой кислотой. К таким солям относится NaAc,KCNи т.п. В частности, гидролиз ацетата натрия протекает по уравнениюNaAc+H2O=HAc+NaOH(или в сокращенной формеAc-+H2O=HAc+OH-) (слабые электролиты представлены в недессоциированной форме). Та как образующееся в результате гидролиза основание представляет собой сильный электролит, то концентрация гидроксид-ионов в растворе превалирует и реакция среды щелочная. Таким образом, соль сильного основания и слабой кислоты гидролизуется с увеличением концентрации гидроксид-ионов в растворе.
Если соль образована слабым основанием и сильной кислотой (NH4Cl,NH4NO3,AlCl3и т.п.), в процессе гидролиза главную роль играет катион соли, связывающий гидроксид-ионы воды в слабое основание. При этом в растворе накапливается избыток катионов водорода и реакция среды становится кислой:NH4Cl+H2O↔NH4OH+HCl(или в сокращенной формеNH4++H2O↔NH4OH+H+). Соль слабого основания и сильной кислоты гидролизуется с увеличением концентрации ионов водорода в растворе. Из привеленных примеров следует, что реакция среды в результате гидролиза определяется тем продуктом гидролиза, который является сильным электролитом.
Сложнее протекает гидролиз солей, образованных слабой кислотой и слабым основанием (NH4CN, (NH4)2CO3,NH4Ac). При этом в реакции гидролиза участвуют и катион, и анион соли, связывающие соответственно гидроксид-ионы и ионы водорода воды. Поэтому реакция среды в результате гидролиза определяется относительной силой образующихся слабой кислоты и слабого основания и, в частности, может быть близка к нейтральной, хотя гидролиз протекает практически полностью.
Например, ацетат аммония гидролизуется по уравнению NH4Ac +H2O↔HAc+NH4OH. Константы ионизации уксусной киcлоты и гидроксида аммония равны K(HAc)=1,76∙10-5 и К(NH4OH)=1,79∙10-5. Этим и объясняется нейтральная реакция среды при гидролизе NH4Ac. При гидролизе цианида аммония NH4CN+H2O↔NH4OH+HCN сравнение констант ионизации кислоты и основания [K(HCN)=7,2∙10-10] позволяет сделать вывод, что реакция среды будет щелочной. Напротив, гидролиз формиата аммония HCOONH4+H2O↔HCOOH+NH4OH характеризуется слабокислой реакцией среды, что подтверждается сравнением констант ионизации муравьиной кислоты (К=1,8∙10-4) и гидроксида аммония.
Итак, при гидролизе солей, образованных одноосновными кислотами и однокислотными основаниями, единственными продуктами гидролиза будут кислота и основание. Соли многоомновных кислот и многокислотных оснований подвергаются ступенчатому гидролизу и в числе продуктов могут образоваться соответственно кислые и основные соли.
I. При гидролизе солей, образованных многоосновными кислотами и однокислотными основаниями, возможны четыре варианта, аналогичные рассмотренным:
1) соли, образованные сильной кислотой и сильным основанием (Na2SO4), гидролизу не подвергаются;
2) соли сильной кислоты и слабого основания гидролизуются ступенчато с образованием кислых солей: (NH4)2SO4+HOH↔NH4HSO4(кислая соль)+NH4OHилиNH4++HOH↔NH4OH+H+(pH<7).
Накапливающиеся в растворе ионы водорода препятствуют протеканию второй ступени гидролиза (до свободной кислоты);
3) при гидролизе солей слабых кислот и сильных оснований образуются кислые соли, но в растворе накапливаются свободные гидроксид-ионы: Na3PO4+HOH↔Na2HPO4+NaOH;PO43-+HOH↔HPO42-+OH-(pH>7). При избытке воды (в сильно разбавленном растворе) гидролиз протекает дальше:Na2HPO4+HOH↔NaH2PO4+NaOH;HPO42-+HOH↔H2PO4-+OH-. При этом гидролиз также не доходит до конца, так как накопление в растворе гидроксид-ионов препятствует образованию ортофосфорной кислотыH3PO4;
4) гидролиз соли слабого основания и слабой кислоты протекает практически до конца с образованием в промежуточной стадии кислых солей: (NH4)2S+HOH↔NH4HS+NH4OH;NH4HS+HOH↔NH4OH+H2S. Таким образом, при ступенчатом гидролизе солей многоосновных кислот и однокислотных оснований всегда образуются кислые моли, а полнота гидролиза определяется относительной силой кислоты и основания.
II. Гидролиз солей многокислотных оснований и одноосновных кислот также протекает ступенчато, но при этом образуются основные соли:
1) соли сильных кислот и сильных оснований (BaCl2) практически не гидролизуются. Однако сильных многокислотных оснований сравнительно немного (гидроксиды щелочно-земельных металлов);
2) соли сильной кислоты и слабого основания, например хлорид алюминия AlCl3, гидролизуются по следующей схеме:AlCl3+HOH↔Al(OH)Cl2(основная соль)+HCl;Al3++HOH↔Al(OH)2++H+(pH<7) и далееAl(OH)Cl2+HOH↔Al)OH)2Cl+HCl;Al(OH)2++HOH↔Al(OH)2++H+. До конца гидролиз не протекает, так как накапливающиеся в растворе ионы Н+препятствуют образованиюAl(OH)3;
3) соли, образованные сильным многокислотным основанием и слабой кислотой, также немногочисленны. Гидролиз цианида бария Ba(CN)2протекает лишь до образования основной соли, но в растворе накапливаются гидроксид-ионы, сообщая ему щелочную реакцию:Ba(CN)2+HOH↔Ba(OH)CN+HCN;CN-+HOH↔HCN+OH-(pH>7);
4) соли слабой кислоты и слабого основания при гидролизе образуют основные соли, а реакция среды зависит от сравнительной силы кислоты и основания: Al(Ac)3+HOH↔Al(OH)(Ac)2+HAc;Al(OH)(Ac)2+HOH↔Al(O)2Ac+HAc.
III. Гидролиз солей многоосновных кислот и многокислотных оснований также может быть представлен четырьмя вариантами:
1) соли сильных кислот и сильных оснований встречаются сравнительно редко и, как правило, нерастворимы в воде (BaSO4);
2) соли сильной кислоты и слабого основания образуют при гидролизе основные соли и свободную кислоту. При этом гидролиз до конца не протекает: Al2(SO4)3+2HOH↔2Al(OH)SO4+H2SO4;Al3++HOH↔Al(OH)2++H+(pH<7);
3) соли, образованные слабой кислотой и сильным основанием, немногочисленны и гидролизуются с образованием кислой соли и свободного основания 2BaS+2HOH↔Ba(HS)2+Ba(OH)2;S2-+HOH↔HS-+OH-(pH>7);
4) соли слабых кислот и слабых оснований полностью гидролизованы в растворе до свободной кислоты и свободного основания: Al2S3+6HOH=2Al(OH)3+3H2S. Такие соли в водных растворах существовать не могут.
С количественной
точки зрения гидролиз в разбавленных
растворах можно охарактеризовать
константой гидролиза. Например, при
гидролизе ацетат-иона Ac-+HOH↔HAc+OH-константа равновесия имеет вид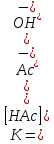 .
Концентрация недиссоциированных молекул
воды постоянна. Тогда
.
Концентрация недиссоциированных молекул
воды постоянна. Тогда есть также величина постоянная и
представляет собой константу гидролиза.
Так как гидролиз определяется диссоциацией
слабой кислоты и воды, то константу
гидролиза удобно связать с константой
ионизации кислоты и ионным произведением
воды. Действительно, умножив числитель
и знаменатель выражения
есть также величина постоянная и
представляет собой константу гидролиза.
Так как гидролиз определяется диссоциацией
слабой кислоты и воды, то константу
гидролиза удобно связать с константой
ионизации кислоты и ионным произведением
воды. Действительно, умножив числитель
и знаменатель выражения на [H+], получим
на [H+], получим .
Так как [H+][OH-]=Kω,a[Ac-][H+]/[HAc]=Ka(HAc),
тоKr=Kω/Ka(HAc).
.
Так как [H+][OH-]=Kω,a[Ac-][H+]/[HAc]=Ka(HAc),
тоKr=Kω/Ka(HAc).
Аналогично, константа гидролиза соли слабого основания и сильной кислоты выражается отношением ионного произведения воды и константы ионизации соответствующего основания. Например, при гидролизе NH4ClKr=Kω/Kb(NH4OH). Константа гидролиза соли слабого основания и слабой кислотыNH4Acопределяется соотношениемKr=Kω/[Ka(HAc)Kb(NH4OH)] (KaиKb- константы ионизации кислоты и основания).
