
- •Общая неорганическая химия.
- •3. Железо и его соединения. Биологическая роль.
- •4. Ионное произведение воды. Водородный показатель.
- •5. Силы Ван-дер-Ваальса.
- •6. Алюминий и его соединения.
- •7. Упругость пара над раствором. Законы Рауля.
- •8. Хром и его соединения. Биологическая роль.
- •9. Ионная связь.
- •10. Бор и его соединения. Биологическая роль.
- •11. Кислородосодержащие кислоты хлора. Соли этих кислот. Биологическая роль.
- •12. Координационная теория Вернера.
- •13. Классификация и изомерия комплексных соединений.
- •14. Щелочные металлы. Биологическая роль.
- •15. Кислородосодержащие кислоты серы. Соли этих кислот.
- •16. Понятие о квантовой механике.
- •17. Многоэлектонные атомы и периодический закон.
- •18. Окисли азота.
- •19. Окислительно-восстановительные реакции.
- •20. Аммиак и его свойства.
- •21. Водородные соединения галогенов. 22. Галогеноводородные кислоты.
- •23. Метод молекулярных орбиталей.
- •24. Теория электролитической диссоциации.
- •25. Константа и степень электролитической диссоциации.
- •26. Азотная кислота и ее соли.
- •27. Гибридизация атомных орбиталей.
- •28. Фосфор и его свойства.
- •29. Периодичность изменения свойств элементов и их соединений.
- •30. Гидролиз.
- •31. Метод валентных связей.
- •32. Благородные газы.
- •33. Термохимические законы.
- •34. Кислород, его физические и химические свойства. Биологическая роль.
- •35. Металлическая связь.
- •36. Хлор и его свойства. Биологическая роль.
- •37. Водород, вода, их физические и химические свойства. Применение в медицине. Биологическая роль.
- •38. Современная химическая атомистика.
- •39. Осмос. Осмотическое давление. Закон Вант Гоффа.
- •40. Сера, ее физические и химические свойства. Биологическая роль.
- •41. Теория Бора.
- •42. Кремний и его соединения. Биологическая роль.
- •43. Скорость химических реакций. Химическое равновесие.
- •44. Понятие об активном комплексе и энергии активации.
- •45. Серная кислота. Соли серной кислоты.
- •46. Растворы. Растворимость как физико-химический прочес (гидратная теория, теория Менделеева).
- •47. Мышьяк и его соединения. Биологическая роль.
42. Кремний и его соединения. Биологическая роль.
Физические св-ва Si.
Сущ в виде 2 аллотропных видоизменений:
1)Амфотерный кремний-бурый порошок, твердый.
2) Кристаллич.-кристалл темно-серый, электропроводный.
Si-хрупок, только при t =800 он стан-ся пластичным вещ-вом. явл полупроводником.
Хим св-ва:
С неМе Si+4F->SiF4;
Si+O2->SiO2;
Si + 2NaOH +H2O-> Na2SiO3 + 2H2;
Si+4HF(г)->SiF4(г) +2H2;
2MgO+Si=SiO2+2Mg
Получение:SiO+2C=Si+2CO
SiCl4+2Zn=Si+2ZnCl2
SiO — смолоподобное аморфное вещ-во, при обычных усл-ях устойчиво к действию О2. Относится к несолеобразующим оксидам. В природе SiO не встреч-ся
.
SiO2 —кремнезем,горный хрусталь, кварц, песок, кремень.Твердое, тугоплавкое в-во, нерастворимо в воде,кислотный оксид.
SiO2 относится к группе стеклообразующих оксидов, то есть склонен к образ-ию переохлажденного расплава — стекла.Один из лучших диэлектриков (электр ток почти не проводит).Имеет атомную кристаллическую решетку. не реаг-щий с водой
Хим св-ва: .Химически стоек к действию кис-т, но реаг-ет с плавиковой кис-той:SiO2 + 6HF → H2[SiF6] + 2H2O.
Со щелочами
С основными окидами, соли силикаты
CaCo3+SiO2=CaSiO3+CO2
SiO2+3C=SiC(карборонд)+2СО
SiH4-cилан, газ с чесночным запахом, ядовитый,самовоспламеняющийся на воздухе.
SiH4+2O2=SiO2+2H2O
H2SiO3-слабая, студенистая.
Биолог. Роль
Для некот орг-мов кремний явл важным биогенным эл-том. Он входит в состав опорных образ-ний у раст-й и скелетных — у животных. В больших кол-вах кремний конц-ют морские орг-мы . Мышечная ткань чел-ка содержит 2% кремния, костная ткань — 4%, кровь — 3,9 мг/л. С пищей в орг-м чел-ка ежедневно поступает до 1г Si. Соед-ния Si относ-но нетоксичны.
43. Скорость химических реакций. Химическое равновесие.
Скорость хим. реакции – это число элементарных актов (соударений) реакций в единицу времени.
С ходом
реакции во времени скорость хим. реакции
уменьшается, поскольку уменьшается
концентрация реагирующих исходных
веществ.Пусть в какое-то время t1концентрация вещества = с1, через
промежутокt2=c2,
тогда выражение для скорости может быть
представлено ,
,
Важно знать
истиннуюскорость хим. реакции, а к
истинной скорости мы приближаемся при .
Выражение для истинной скорости
записывается
.
Выражение для истинной скорости
записывается ,
т.е. истинная скорость берется как первая
производная от концентрации по времени.
,
т.е. истинная скорость берется как первая
производная от концентрации по времени.
Выражение для истинной скорости может быть записано в виде закона действующих масс. H2+I2= 2HI.
Закон
действующих масс.Скорость хим. реакции
прямопропорциональна произведению
концентрации реагирующих веществ(Скорость прямой реакции в этой системе
записывается
 .
Выражение для обратной хим. реакции
.
Выражение для обратной хим. реакции ,
где
,
где =const υ этих реакций.
Физ. смысл этих констант состоит в том,
что они равны скоростям реакций
=const υ этих реакций.
Физ. смысл этих констант состоит в том,
что они равны скоростям реакций
 ,
, ,
когда концентрации реагирующих веществ
равны 1).
,
когда концентрации реагирующих веществ
равны 1).
Константа равновесия хим. реакций.
хим. равновесие – это такое состояние реакционной системы, когда прямая и обратная реакция идут с одинаковыми скоростями (в противоположных направлениях). Это состояние хим. равновесия может сохраняться сколь угодно долго, если на систему не оказывают влияния какие-либо факторы (давление, температура, концентрация).
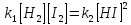 ,
, ,
, –
постоянная величина.K=
–
постоянная величина.K= – получаем выражение для константы
равновесия этой реакции.
– получаем выражение для константы
равновесия этой реакции.
Константа
равновесия – это отношение произведения
концентрации продуктов реакции к
произведению концентраций исходных
веществ. Для каждой обратимой хим.
реакции в конкретных условиях как бы
характеризует собой тот предел, до
которого идет хим. реакция. Если, например
 (концентрация исходных веществ
увеличивается), то мы приходим к
необратимой реакции. Если
(концентрация исходных веществ
увеличивается), то мы приходим к
необратимой реакции. Если ,
то равновесия все больше и больше
смещается вправо, т.е. реакция не
протекает.
,
то равновесия все больше и больше
смещается вправо, т.е. реакция не
протекает.
Факторы, влияющие на к:
1)давление(
2)температура. К1 и к2 изменяются не в одинаковой степени.
3)изменение с не влияет на k, а приводит к смещению равновесия
Истинное хим. равновесие и его признаки.
Оно является подвижным, динамичным, в случае этого равновесия прямая и обратная реакции идут с одинаковыми скоростями. Это равновесие можно сместить в ту или иную сторонц действием каких-либо факторов. Но при отмене действия этих факторов система возвращается в исходное состояние
От истинного равновесия следует отличать ложное равновесие. Они близки к истинам по признаку неизменности равновесного состояния во времени, если на систему не оказывают влияние какие-либо внешние факторы. При размораживании этого (ложного) равновесного состояния чем-либо в системе протекает необратимо идущий процесс.
(В темноте система H2 + Cl2 существует сколь угодно долго, при освещении в ней протекает необратимо-идущий процесс с образованием HCl. При прекращении освещения мы не вернем H2 и Cl2.
