
- •Общая неорганическая химия.
- •3. Железо и его соединения. Биологическая роль.
- •4. Ионное произведение воды. Водородный показатель.
- •5. Силы Ван-дер-Ваальса.
- •6. Алюминий и его соединения.
- •7. Упругость пара над раствором. Законы Рауля.
- •8. Хром и его соединения. Биологическая роль.
- •9. Ионная связь.
- •10. Бор и его соединения. Биологическая роль.
- •11. Кислородосодержащие кислоты хлора. Соли этих кислот. Биологическая роль.
- •12. Координационная теория Вернера.
- •13. Классификация и изомерия комплексных соединений.
- •14. Щелочные металлы. Биологическая роль.
- •15. Кислородосодержащие кислоты серы. Соли этих кислот.
- •16. Понятие о квантовой механике.
- •17. Многоэлектонные атомы и периодический закон.
- •18. Окисли азота.
- •19. Окислительно-восстановительные реакции.
- •20. Аммиак и его свойства.
- •21. Водородные соединения галогенов. 22. Галогеноводородные кислоты.
- •23. Метод молекулярных орбиталей.
- •24. Теория электролитической диссоциации.
- •25. Константа и степень электролитической диссоциации.
- •26. Азотная кислота и ее соли.
- •27. Гибридизация атомных орбиталей.
- •28. Фосфор и его свойства.
- •29. Периодичность изменения свойств элементов и их соединений.
- •30. Гидролиз.
- •31. Метод валентных связей.
- •32. Благородные газы.
- •33. Термохимические законы.
- •34. Кислород, его физические и химические свойства. Биологическая роль.
- •35. Металлическая связь.
- •36. Хлор и его свойства. Биологическая роль.
- •37. Водород, вода, их физические и химические свойства. Применение в медицине. Биологическая роль.
- •38. Современная химическая атомистика.
- •39. Осмос. Осмотическое давление. Закон Вант Гоффа.
- •40. Сера, ее физические и химические свойства. Биологическая роль.
- •41. Теория Бора.
- •42. Кремний и его соединения. Биологическая роль.
- •43. Скорость химических реакций. Химическое равновесие.
- •44. Понятие об активном комплексе и энергии активации.
- •45. Серная кислота. Соли серной кислоты.
- •46. Растворы. Растворимость как физико-химический прочес (гидратная теория, теория Менделеева).
- •47. Мышьяк и его соединения. Биологическая роль.
33. Термохимические законы.
Существует 2 шкалы определения тепловых эффектов реакций:
1. Термохимическая – тепловой эффект экзотермической реакции является положительным и обозначаются +Q; тепловой эффект эндотермической реакции считается отрицательной и обозначается –Q.
Н2 + I2 = 2HI + 17 кДж; 2HI = H2 + I2 – 17 кДж
2.
Термодинамическая
(все наоборот) – тепловой эффект
экзотермической реакции считается
отрицательным и обозначается -
 Н,
эндотермической реакции считается
положительной и обозначается +
Н,
эндотермической реакции считается
положительной и обозначается + Н.H2
+ I2
= 2HI,
Н.H2
+ I2
= 2HI,
 Н
– 17 кДж
Н
– 17 кДж
Химическая термодинамика изучает взаимосвязь между изменением энергии системы и превращением вещества.
Н – функция состояния системы; - энтальпия (теплосодержание системы)
Н=U + pV, где U – внутренняя энергия системы (сумма потенциальной и кинетической энергии частиц, входящих в систему).
Термохимич.закон Лаваузе-Лапласа:
Тепловой эффект прямой реакции равен по знаку и противоположен по направлению тепл.эф. обратной химич. р-ции.
Термохимический закон Гесса":
Тепловой
эффект химической реакции зависит лишь
от начального и конечного состояния
системы и не зависит от пути, по которому
реакция осуществляется.
 Н
=
Н
= Н1
+
Н1
+
 Н2
Н2
C
+ O2
= CO2
-
 Н
= 393,5 кДж/моль
Н
= 393,5 кДж/моль
I.
C
+ ½O2
= CO
-
 Н1
- 110,5 кДж/моль
Н1
- 110,5 кДж/моль
II.
CO + ½O2
= CO2
-
 Н2
-283,0 кДж/моль
Н2
-283,0 кДж/моль
Важность этого закона состоит в том, что он позволяется теоритически рассчитывать величины тепловых эффектов тех стадий реакций, экспериментальное определение которых невозможно или затруднительно
Из закона Гесса вытекают два важных следствия:
1.Тепловой эффект химической реакции не зависит от времени ее протекания.
2. Тепловой эффект хим. Реакции равен разности между суммами энтальпий образования продуктов реакции и суммами энтальпий образования исходных веществ. (с учетом стехиометрических коэффициентов).
2А
+ 3В = Д + 2Р -
 Н;
2 ·
Н;
2 · НА
+ 3 ·
НА
+ 3 ·
 НВ
= 1 ·
НВ
= 1 ·
 НД
+ 2 ·
НД
+ 2 ·
 НР
; 2-1.
НР
; 2-1.
В химической термодинамике существует некое выражение:
 G
=
G
=
 Н
-T
Н
-T S,
где T
– абсолютная температура; G
– термодинамическая функция – энергия
Гиббса; S
– энтропия –
S,
где T
– абсолютная температура; G
– термодинамическая функция – энергия
Гиббса; S
– энтропия –
По
изменению
 G
судят о возможности или невозможности
самопроизвольного протекания процесса.
Если
G
судят о возможности или невозможности
самопроизвольного протекания процесса.
Если
 G<0,
то самопроизвольный процесс в системе
возможен. Если
G<0,
то самопроизвольный процесс в системе
возможен. Если
 G>0,
то самопроизвольный процесс в системе
невозможен.
G>0,
то самопроизвольный процесс в системе
невозможен.
N2
+ 2H2O
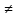 NH4NO2
,
NH4NO2
,
 G>0;
NH4NO2
= N2
+ 2H2O
,
G>0;
NH4NO2
= N2
+ 2H2O
,
 G<0
G<0
34. Кислород, его физические и химические свойства. Биологическая роль.
В свободном виде кислород — газ без цвета, запаха и вкуса. 21% по объему.
Особенности строения молекулы О2: атмосферный кислород состоит из двухатомных молекул. Молекулярный кислород (газообразный и жидкий) — парамагнитное вещество, в каждой молекуле О2 имеется по 2 неспаренных электрона. Этот факт можно объяснить тем, что в молекуле на каждой из двух разрыхляющих орбиталей находится по одному неспаренному электрону. ММО
Физические и химические свойства: в свободном виде встречается в виде двух модификаций О2 («обычный» кислород) и О3 (озон).
Высокая прочность химической связи между атомами в молекуле О2 приводит к тому, что при комнатной температуре газообразный кислород химически довольно малоактивен.
Получение: сжижение воздуха, электролиз воды.
Химические св-ва:
С Ме. 3Fe+2O2=Fe3O4(окись, закись железа)( оксиды, перекиси)
С неМе:N2+O2=2NO
Cо сложными в-вами: 2NO+O2=2NO2
4FeS2+11O2=2Fe2O3+8SO2
SO2+O2=2SO3
При нагревании, даже небольшом, химическая активность кислорода резко возрастает. При поджигании он реагирует с взрывом с водородом, метаном, другими горючими газами.
Не взаимодействует с благородными газами, платиновыми ме( Os), с галогенами(F), золотом и серебром
Бинарные соединения кислорода, в которых степень окисления атомов кислорода равна –2, называют оксидами (прежнее название — окислы).
Кислород образует также соединения, в которых его степень окисления равна –1. Это — пероксиды (старое название — перекиси), например, пероксид водорода Н2О2, пероксид бария ВаО2, пероксид натрия Na2O2 и другие. В этих соединениях содержится пероксидная группировка — О — О —.
С активными щелочными металлами, например, с калием, кислород может образовывать также супероксиды, например, КО2 (супероксид калия), RbO2 (супероксид рубидия). В супероксидах степень окисления кислорода –1/2. Можно отметить, что часто формулы супероксидов записывают как К2О4, Rb2O4 и т.д.
С самым активным неметаллом фтором кислород образует соединения в положительных степенях окисления. Так, в соединении O2F2 степень окисления кислорода +1, а в соединении O2F — +2. Эти соединения принадлежат не к оксидам, а к фторидам.
Биологическая роль: Содержание кислорода в организме взрослого человека составляет около 62% от общей массы тела (43 кг на 70 кг массы тела).
Кислород входит в состав молекул множества веществ - от самых простых до сложных полимеров; наличие в организме и взаимодействие этих веществ обеспечивает существование жизни. Являясь составной частью молекулы воды, кислород участвует практически во всех биохимических процессах протекающих в организме.
Кислород незаменим, при его недостатке эффективным средством может быть только восстановление нормального снабжения организма кислородом. Даже кратковременное (несколько минут) прекращение поступления кислорода в организм может вызвать тяжелые нарушения его функций и последующую смерть.
Главной функцией молекулярного кислорода в организме является окисление различных соединений. Вместе с водородом кислород образует воду, содержание которой в организме взрослого человека в среднем составляет около 55-65%.
Кислород входит в состав белков, нуклеиновых кислот и других жизненно-необходимых компонентов организма. Кислород необходим для дыхания, окисления жиров, белков, углеводов, аминокислот, а также для многих других биохимических процессов.
