
- •2. Марганец и его соединения. Биологическая роль.
- •3. Железо и его соединения. Биологическая роль.
- •4. Ионное произведение воды. Водородный показатель.
- •5. Силы Ван-дер-Вальса.
- •7. Упругость пара над раствором. Законы Рауля.
- •9. Ионная связь.
- •11. Кислородосодержащие кислоты хлора. Соли этих кислот. Биологическая роль.
- •12. Координационная теория Вернера.
- •13. Классификация и изомерия комплексных соединений.
- •15. Кислородосодержащие кислоты серы. Соли этих кислот.
- •16. Понятие о квантовой механике.
- •17. Многоэлектонные атомы и периодический закон.
- •18. Окисли азота.
- •19. Окислительно-восстановительные реакции.
- •20. Аммиак и его свойства.
- •21. Водородные соединения галогенов. 22. Галогеноводородные кислоты.
- •23. Метод молекулярных орбиталей.
- •25. Константа и степень электролитической диссоциации.
- •26. Азотная кислота и ее соли.
- •27. Гибридизация атомных орбиталей.
- •29. Периодичность изменения свойств элементов и их соединений.
- •30. Гидролиз.
- •32. Благородные газы.
- •35. Металлическая связь.
- •38. Современная химическая атомистика.
- •39. Осмос. Осмотическое давление. Закон Вант Гоффа.
- •41. Теория Бора.
- •43. Скорость химических реакций. Химическое равновесие.
- •44. Понятие об активном комплексе и энергии активации.
- •45. Серная кислота
- •46. Растворы. Растворимость как физико-химический прочес (гидратная теория, теория Менделеева).
23. Метод молекулярных орбиталей.
– квантово-химический метод описания химической связи, рассматривающий молекулу и любую многоатомную систему как "многоядерный" атом, в котором электроны заселяются по молекулярным орбиталям. В методе молекулярных орбиталей для описания распределения электронной плотности в молекуле используется представление о молекулярной орбитали (подобно атомной орбитали для атома). Молекулярные орбитали - волновые функции электрона в молекуле или другой многоатомной химической частице. Каждая молекулярная орбиталь (МО), как и атомная орбиталь (АО), может быть занята одним или двумя электронами. Состояние электрона в области связывания описывает связывающая молекулярная орбиталь, в области разрыхления - разрыхляющая молекулярная орбиталь. Энергии связывающих орбиталей ниже, чем энергии атомных орбиталей, использованных для их образования. Электроны, заселяющие связывающие молекулярные орбитали, находятся преимущественно в пространстве между связываемыми атомами, т.е. в так называемой области связывания. Энергии разрыхляющих орбиталей выше, чем энергии исходных атомных орбиталей. Заселение разрыхляющих молекулярных орбиталей электронами способствует ослаблению связи: уменьшению ее энергии и увеличению расстояния между атомами в молекуле. Распределение электронов по молекулярным орбиталям происходит по тем же правилам, что и распределение электронов по атомным орбиталям в изолированном атоме. Молекулярные орбитали образуются при определенных комбинациях атомных орбиталей. Их число, энергию и форму можно вывести исходя из числа, энергии и формы орбителей атомов, составляющих молекулу.
В общем случае, волновые функции, отвечающие молекулярным орбиталям в двухатомной молекуле, представляют как сумму и разность волновых функций атомных орбитале, умноженных на некоторые постоянные коэффициенты, учитывающие долю атомных орбиталей каждого атома в образовании молекулярных орбиталей (они зависят от электроотрицательности атомов):φ(АВ) = с1Ѱ(А) ± с2 Ѱ (В)Оценить возможность или невозможность образования связи этим методом можно, зная величину порядка связиn.Порядок связи– это дробь, в числителе которой располагается разница между числом электронов на связывающей и разрыхляющей орбиталях, а в знаменателе число взаимодействующих атомов. Если порядок связи равен 0, то молекула (ион) не существует.
24. Теория
электролитической диссоциации.ЭД-это процесс распада веществ на ионы
при растворении или расплавлении.В 1887
году шведс Аррениус показал, что в
растворах молекулы веществ распадаются
на составные части – катионы и анионы.
Носят название электролиты. Позднее
русские ученые Каблуков и Кистяковский
на основе основной химической теории
доказали, что диссоциация протекает
под воздействием молекул воды с
образованием гидратированных веществ
(гидратов):КА +mH2O=K+· (H2O)n+A-(H2O)p.При
растворении соединений с ионными связями
(например, NaCl) процесс гидратации
начинается с ориентации диполей воды
вокруг всех выступов и граней кристаллов
соли.Ориентируясь вокруг ионов
кристаллической решетки, молекулы воды
образуют с ними либо водородные, либо
донорно-акцепторные связи. При этом
процессе выделяется большое количество
энергии, которая называется энергией
гидратации.Энергия гидратации, величина
которой сравнима с энергией кристаллической
решетки, идет на разрушение кристаллической
решетки. При этом гидратированные ионы
слой за слоем переходят в растворитель
и, перемешиваясь с его молекулами,
образуют раствор.Наблюдаемое различие
в коллигативных свойствах разбавленных
растворов электролитов и неэлектролитов
объясняется тем, что из-за ЭД увеличивается
общее число частиц в растворе. Это, в
частности, приводит к увеличению
осмотического давления раствора
сравнительнос растворами неэлектролитов,
понижению давления пара растворителя
над раствором, увеличению изменения
температуры кипения и замерзания
раствора относительно чистого
растворителя. ЭД объясняется также
ионная электропроводность
электролитов.Количественно процесс
диссоциации можно просчитатьс помощью
степени электролитической диссоциации
(альфа) и константы электролитической
диссоциации (k). Α= (число
расп.молекул к числу всех молекул) иk=
(число
расп.молекул к числу всех молекул) иk=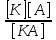 .Исходя
из этого электролиты(проводят ток
вследствие диссоциации):Слабые(<1),средние,сильные(=1
полностью диссоциируют).Факторы,
влияющие на степень:1. Природа раств
в-ва.2.Природа р-ля.3. Т.4. С: разбавление
раствора приводит к увеличению степ
ЭД.5. Влияние одноименного иона, приводящее
к уменьшению степени ЭД: при введениив
р-р слабой уксусную кислоты, равновесие
диссоциации ее соли (ацетата аммония)
от влияния, создаваемого избытком ацетат
ионов, создаваемого солью, смещается
влево. Учитывая, что при электролитической
диссоциации электролитов количество
частиц в растворе растет, выше рассмотренные
законы и следствия для растворов
неэлектролитов в применении к электролитам
несколько видоизменяются, например:
.Исходя
из этого электролиты(проводят ток
вследствие диссоциации):Слабые(<1),средние,сильные(=1
полностью диссоциируют).Факторы,
влияющие на степень:1. Природа раств
в-ва.2.Природа р-ля.3. Т.4. С: разбавление
раствора приводит к увеличению степ
ЭД.5. Влияние одноименного иона, приводящее
к уменьшению степени ЭД: при введениив
р-р слабой уксусную кислоты, равновесие
диссоциации ее соли (ацетата аммония)
от влияния, создаваемого избытком ацетат
ионов, создаваемого солью, смещается
влево. Учитывая, что при электролитической
диссоциации электролитов количество
частиц в растворе растет, выше рассмотренные
законы и следствия для растворов
неэлектролитов в применении к электролитам
несколько видоизменяются, например:
Закон
Вант-Гоффа для электролитов – росм= ί ·CRT, где ί- изотонический
коэффициент. Он представляет собой (
(
 ,
где в числителе стоят эксперимент, а в
знаменателе теорет .Зав-ть характера
диссоциации гидроксидов от заряда центр
иона и его радиуса.Э-О-Н .В 3 периоде →
заряд ↑, радиус ↓. Поэтому в этом
направлении связь Э – О усиливается, а
связь О – Н ослабевает. Поэтому →по
этому ряду осн св-ва ↓, а кисл ↑.
,
где в числителе стоят эксперимент, а в
знаменателе теорет .Зав-ть характера
диссоциации гидроксидов от заряда центр
иона и его радиуса.Э-О-Н .В 3 периоде →
заряд ↑, радиус ↓. Поэтому в этом
направлении связь Э – О усиливается, а
связь О – Н ослабевает. Поэтому →по
этому ряду осн св-ва ↓, а кисл ↑.
