
- •2. Марганец и его соединения. Биологическая роль.
- •3. Железо и его соединения. Биологическая роль.
- •4. Ионное произведение воды. Водородный показатель.
- •5. Силы Ван-дер-Вальса.
- •7. Упругость пара над раствором. Законы Рауля.
- •9. Ионная связь.
- •11. Кислородосодержащие кислоты хлора. Соли этих кислот. Биологическая роль.
- •12. Координационная теория Вернера.
- •13. Классификация и изомерия комплексных соединений.
- •15. Кислородосодержащие кислоты серы. Соли этих кислот.
- •16. Понятие о квантовой механике.
- •17. Многоэлектонные атомы и периодический закон.
- •18. Окисли азота.
- •19. Окислительно-восстановительные реакции.
- •20. Аммиак и его свойства.
- •21. Водородные соединения галогенов. 22. Галогеноводородные кислоты.
- •23. Метод молекулярных орбиталей.
- •25. Константа и степень электролитической диссоциации.
- •26. Азотная кислота и ее соли.
- •27. Гибридизация атомных орбиталей.
- •29. Периодичность изменения свойств элементов и их соединений.
- •30. Гидролиз.
- •32. Благородные газы.
- •35. Металлическая связь.
- •38. Современная химическая атомистика.
- •39. Осмос. Осмотическое давление. Закон Вант Гоффа.
- •41. Теория Бора.
- •43. Скорость химических реакций. Химическое равновесие.
- •44. Понятие об активном комплексе и энергии активации.
- •45. Серная кислота
- •46. Растворы. Растворимость как физико-химический прочес (гидратная теория, теория Менделеева).
38. Современная химическая атомистика.
Все вещества, независимо от их агрегатного состояния, состоят из огромного числа частиц (молекул, атомов или ионов), эти частицы непрерывно и хаотически движутся, а также взаимодействуют между собой. Эти положения имеют опытное подтверждение.Начало в 1801 г. науч спор франц. Прустом и Бертолле.З.постоянства состава Пруста «Состав хим.соединения и его св-ва остается постоянным, независимо от способа его получения». Спор обратил внимание на колич соотношения компонентов в составе хим соед. С современных позиций:если в-ву отвечает мол.структура(газ,пар),то его состав не зависит от сп.получ. т.к.малочисленный состав молекул (P4 (пар), S6 (пар), As4 (пар), CO2 (газ)I2 тв) не позволяет менять их состав.Они наблюдаются в паровой фазе при испарении мет, ков и ионных тв тел (Na2, C2,NaCl), а также в мол кристаллах, в кот. сущ отдельные молы из неб кол-ва атомов: I2 (тв), CO2(тв). Эти молекулы связаны между собой слабыми вандерваальсовыми силами и поэтому легко возгоняются.Если-координац.структура,то его состав сильно зависит от сп,усл получ и обработки.В ков-ионных кристаллах нельзя зафиксировать отдельные молекулы(NaCl^Naокружен6Сlи наоборот).Такие кристаллы - координационными, и для них понятие молекулы, которое определяет все свойства молекулярного кристалла, за меняется понятием «фаза»-носитель св-в в-в с немолек.структурой.От её состава м строения зависят свойства., кот. распространяется на весь кристалл.Действует закон больших чисел.:координ. кристалл, содержащий очень большое кол-во атомов, может устойчиво существовать, даже если какое-то число последних по определенным причинам покинет кристалл. Реально существующий кристалл (в отличие от идеального) при Т> 0 К всегда содержит определенное число пустых мест в узлах кристаллич. решетки (далее – вакансий) и его устойчивость может даже возрастать с увеличением концентрации дефектов – нарушений идеальной кристаллич.структуры.Следствие:Закон эквивалентов.
Для мол соединений мас кол-ва составляющих Э соответствуют хим эквивалентам; при отсутствии мол структуры -мас кол-ва составляющих Э могут отклоняться от значений их хим эквивалентов.Закон кратных отношений:Если два Э образуют неск мол соединений, то массовые кол-ва одного Э, приходящееся на одно и то же мас кол-во др, относятся между собой как небольшие целые числа. Для соед. немолекулярную стр, отношения мас кол-в м.б дроб числами.
39. Осмос. Осмотическое давление. Закон Вант Гоффа.
Осмос– это процесс односторонней диффузии молекул растворителя через мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией.
Давление, которое возникает при этом, называется осмотическим давлением, т.е. это то давление, которое нужно приложить к раствору, чтобы осмос прекратился. Его можно измерить.
Голландский
ученый Вант-Гофф, используя уравнение
Менделеева-Клапейрона: pV=nRT(p=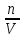 RT)
RT)
Pосм= сRT– закон Вант-Гоффа в применении к растворам неэлектролитов для осмотического давления; - в большей степени применим к разбавленным растворам.
Закон Вант-Гоффа.Осмотическое давление раствора неэлектролита равно тому газовому давлению, которое оказывали бы частицы растворенного вещества, если бы они занимали объем раствора.
Законы Рауля, следствия из них, закон Вант-Гоффа не оправдываются в том случае, если приходится иметь дело с электролитами.
40. Сера.В=2,4,6.степ.окисления= +6, +4, +2, 0, -1, −2Наиболее стабильны циклические мол-лы S8, имеющие форму короны, образ-щие ромбическую и моноклинную S. Это кристаллическая сера — хрупкое вещ-во жёлтого цвета, без вкуса и запаха, легко раствор в CS2. В воде сера нерастворима. некот её модификации раств-ся в органич-ких раств-лях, напр сероуглероде, скипидаре. Плавление S сопров-ся заметным увеличением объёма. Распл-ная S представляет собой жёлтую легкоподвижную жидкость.Широко распространена в природе:сульфидыFeS2-пирит,сфалерит,PbS-галенит,ангидритCaSO4,баритBaSO4,гипсCuSO4*2H2O.Получение:по скважине в её подз.залежи под давлением при Т закачивается перегретая вода,перейдя в распл.состояние сера поднимается на пов-ть.Ещё термич.разложением в шахтных печах пирита:FeS2=FeS+S\2H2S+O2=2S+H2OХим св-ва S:Сера реаг-т со щелочными ме без нагревания:
2Na + S -> Na2S c остальными ме (кроме Au, Pt) - при повышенной t°:
2Al+ 3S -> Al2S3;Zn+S -> ZnS2) С некот неметаллами сера обр-т бинарные соед-ния:
H2 + S -> H2S; 2P + 3S -> P2S3; C + 2S ®->CS2.\ S + O2 –>t° S+4O2\2S + 3O2 –>t°; 2S+6O3;
4)c галогенами (кромейода):S + Cl2->S+2Cl2; 5)c кис-ми – окис-лями: S + 2H2SO4(конц) ->3S+4O2 + 2H2O; S + 6HNO3(конц) -> H2S+6O4 + 6NO2 + 2H2O;
7)сера раствор-ся в конц-ном рас-ре сульфита натрия:
S + Na2S+4O3 ->Na2S2O3 тиосульфатнатрия.
C раст-ми сульфидов щелочных ме: S + Na2S-> Na2S2.Сероводород: Газ, бесцветный, с запахом тухлых яиц, ядовит, растворим в воде, H2S + 2NaOH =Na2S + 2H2O\ H2S-2 + Br2 = S0 + 2HBr\H2S-2 + 2FeCl3= 2FeCl2 + S0 + 2HCl\H2S-2 + 4Cl2 + 4H2O= H2S+6O4 + 8HCl\3H2S-2 + 8HNO3(конц) =3H2S+6O4 + 8NO + 4H2O\H2S-2 + H2S+6O4(конц= S0 + S+4O2 + 2H2O.\ H2S-2 + O2 =2S0 + 2H2O,при избытке O2: 2H2S-2 + 3O2 =2S+4O2 + 2H2O.Кач.реакция: H2S + Pb(NO3)2 = PbS¯ + 2HNO3. SO2 (сернистый газ): S + O2 = SO2\ Ba(OH)2 + SO2 = BaSO3+ H2O\ SO2 + H2O = H2SO3-средняя к-та\окисление SO2 + Br2 + 2H2O ® H2SO4 + 2HBr\5SO2 + 2KMnO4 + 2H2O ® K2SO4 + 2MnSO4 + 2H2SO\восстанов SO2 + С = S + СO2\SO2 + 2H2S = 3S + 2H2O\SO3- Бесцветная летучая жидкость, t°пл. = 17°C;t°кип. = 66°С; на воздухе "дымит", сильно поглощает влагу (хранят в запаянных сосудах) 2SO2 + O2 = 2SO3\.SO3 +H2O=H2SO4/2NaOH + SO3 ® Na2SO4 + H2O/КислотаBaCl2 + H2SO4 =BaSO4 + 2HCl\ CuO + H2SO4 =CuSO4 + H2O\ С + 2H2SO4(конц) = C+4O2 + 2S+4O2 + 2H2O.Применение:мин.удобрения,ядохимикаты,взрывч.в-ва,смазоч.в-ва,в СХ,спички,резина,косметич,бумаж пром-ти,пищевая и текстильн,гипс-строительн,фотодело,фарм-противомикроб,стомат,антисептич и рвотное ЛС-медный купорозCuSO4*5H2O,рентгенография-BaSO4(способен поглащать излуч),при чесотке,дезинфекция помещений,успокаивает НС,при отравлениях тяж.Ме.Биол.роль:120г,S — один из биогенных элем-тов.сут.потреб=4г с молоком,капустой,сыром,яйца,рыба,фасоль,говядина. S входит в состав некоторых аминокислот (цистеин, метионин), витаминов (биотин, тиамин), ферментов. S участвует в образ-нии третичной структуры белка (формирование дисульфидных мостиков). ОВР S — источник энергии в хемосинтезе. Человек содержит примерно 2 г S на 1 кг своего веса.Недостаток-кожа,выпадение волос,тахикардия,суставы,наруш обмен,раздраж-ть.
