
- •2. Марганец и его соединения. Биологическая роль.
- •3. Железо и его соединения. Биологическая роль.
- •4. Ионное произведение воды. Водородный показатель.
- •5. Силы Ван-дер-Вальса.
- •7. Упругость пара над раствором. Законы Рауля.
- •9. Ионная связь.
- •11. Кислородосодержащие кислоты хлора. Соли этих кислот. Биологическая роль.
- •12. Координационная теория Вернера.
- •13. Классификация и изомерия комплексных соединений.
- •15. Кислородосодержащие кислоты серы. Соли этих кислот.
- •16. Понятие о квантовой механике.
- •17. Многоэлектонные атомы и периодический закон.
- •18. Окисли азота.
- •19. Окислительно-восстановительные реакции.
- •20. Аммиак и его свойства.
- •21. Водородные соединения галогенов. 22. Галогеноводородные кислоты.
- •23. Метод молекулярных орбиталей.
- •25. Константа и степень электролитической диссоциации.
- •26. Азотная кислота и ее соли.
- •27. Гибридизация атомных орбиталей.
- •29. Периодичность изменения свойств элементов и их соединений.
- •30. Гидролиз.
- •32. Благородные газы.
- •35. Металлическая связь.
- •38. Современная химическая атомистика.
- •39. Осмос. Осмотическое давление. Закон Вант Гоффа.
- •41. Теория Бора.
- •43. Скорость химических реакций. Химическое равновесие.
- •44. Понятие об активном комплексе и энергии активации.
- •45. Серная кислота
- •46. Растворы. Растворимость как физико-химический прочес (гидратная теория, теория Менделеева).
3. Железо и его соединения. Биологическая роль.
В=до 6 (4s2) и (3d6). Степ.окис= +2, +3 и, иногда, +6.
Нахождение в природе
В свободном состоянии железо встречается только в метеоритах.Наиболее важные природные соединения:Fe2O3 3H2O – бурый железняк;Fe2O3 – красный железняк;Fe3O4(FeOFe2O3) – магнитный железняк;FeS2 - железный колчедан (пирит).Получение железа
В промышленности железо получают восстановлением его из железных руд углеродом (коксом) и оксидом углерода (II) в доменных печах:3Fe2O3+CO= 2Fe3O4+CO2,Fe3O4+CO= 3FeO+CO2,FeO+CO=Fe+CO2.Серебристо серый металл, обладает большой ковкостью, пластичностью и сильными магнитными свойствами(ферромагнетик).Имеет две крист.модификации:объемноцентрированную кубич, гранецентрированной кубич)-зависит от Т.
В реакциях железо является вос-лем. Однако при обычной Т оно не взаимодействует даже с галогенами, O,S), но при нагревании:2Fe + 3Cl2= 2FeCl3;3Fe + 2O2= Fe3O4(FeOFe2O3); Fe + S = FeS;
При оч выс Т:3Fe + C = Fe3C ;3Fe + Si = Fe3Si ;3Fe + 2P = Fe3P2На воздухе окис-ся:4Fe + 3O2+ 6H2O = 4Fe(OH)3,Только при высокой температуре:3Fe + 4H2O = Fe3O4+ 4H2.С к-тамиFe+ 2HCl(H2SO4)=FeCl2+H2.При обыч Т железо не взаимодействует с концH2SO4.При нагревании конц:2Fe+ 6H2SO4=Fe2(SO4)3+ 3SO2+ 6H2O.Разб:Fe+ 4HNO3=Fe(NO3)3+NO+ 2H2O.(конц-нет)
Fe+CuSO4=FeSO4+Cu,Fe0+Cu2+=Fe2++Cu0.Соединения железа (II)FeO – черн крист, нераств в воде. получают:Fe3O4+ CO = 3FeO + CO2. FeO + 2HCl = FeCl2+ H2O.Fe(OH)2– порошок бел, не раств в воде. Получают:FeSO4+ 2NaOH=Fe(OH)2+Na2SO4,проявляет св-ва основанияFe(OH)2+ 2HCl=FeCl2+ 2H2O,При Т:Fe(OH)2= FeO + H2O.+2 проявляют восст свойства, так как Fe2+легко окисляются до Fe+3:Так, свежеполученный зеленоватый осадок на воздухе буреет:4Fe+2(OH)2+O2+ 2H2O= 4Fe+3(OH)3.Качественная реакция на катион железа (II).Реактивом катиона железа Fe2+ является красная кровяная соль K3[Fe(CN)6] =темно-синий осадок – турнбулева синь.Соединения железа (III)Fe2O3– порошок бур не раствв воде. амф свойства:при высокой температуре:Fe2O3+ 2NaOH= 2NaFeO2 +H2O,При взаимодействии с разб кислотами Fe(OH)3легко образует соответствующие соли:Fe(OH)3+ 3HClFeCl3+ H2O.При Т:Fe(OH)3+NaOH=Na[Fe(OH)4],Кач реакции Fe3+желтая кровяная сольK2[Fe(CN)6].=темно-синий осадок – берлинская лазурь:4FeCl3+ 3K4[Fe(CN)6]Fe4[Fe(CN)6]3+12KCl,Или с помощ.роданида аммония=кроваво-красного цвета:FeCl3+ 3NH4CNSFe(CNS)3+ 3NH4Cl.Нулевая и отриц.степени-в комплесах.0-Fe(CO)5.Применение:создание чугунов и сталей,ферраты-в вычисл,радио,запомин.технике,квасцы-коагулянты при очистке воды,текстильн.пром-ти,берлинская лазурь-основа для масл.красок син и зел;сульфат в мед и ветеринарии для лечения анемии.Биологическая роль:важнейших микроЭ =4 г ,в состав гемоглобина, миоглобина, различных ферментов и др. комплексов, кот в печени и селезенке; стимулирует кроветворение.
4. Ионное произведение воды. Водородный показатель.
Вода служит
не только наиболее распространенным
растворителем для многих электролитов,
но и сама является идеальным
амфолитом(диссоциирует как к-та и как
осн-ие). В соответствии с равновесиемН20
Н+
+OH- в воде
присутствуют катионы водорода и
гидроксид-анионы в строго эквивалентных
количествах. Но вода –весьма слабый
электролит.Константа ионизации водыКИ
= [Н*][0Н-]/[Н20]= .
Отсюда [Н+] + [ОН-]=1,8∙10-16 ∙
55,56=10-14. Величина [Н+] +
[ОН-]=10-14 называется ионным
произведением воды. При добавлении
кислоты [Н+] увеличивается и
уменьшается [ОН-], поскольку при
данной Т ионное произведение воды —
величина постоянная. При добавлении
щелочи -наоборот. Таким образом,
концентрация ионов водорода в растворе
может служить мерой кислотности или
щелочности среды. В кислых растворах
[Н+] > 10"7, в щелочных [Н+]
< 10"7.В данном случ реакция
среды выр-ся колич-но через концентрацию
моль/л.А можно через отрицательного
десятичного логарифма концентрации
водородных ионов, которое называют
водородным показателем:pH=-lg[H+](у
воды=7,меньше-кислоты) для нейтральной
среды
.
Отсюда [Н+] + [ОН-]=1,8∙10-16 ∙
55,56=10-14. Величина [Н+] +
[ОН-]=10-14 называется ионным
произведением воды. При добавлении
кислоты [Н+] увеличивается и
уменьшается [ОН-], поскольку при
данной Т ионное произведение воды —
величина постоянная. При добавлении
щелочи -наоборот. Таким образом,
концентрация ионов водорода в растворе
может служить мерой кислотности или
щелочности среды. В кислых растворах
[Н+] > 10"7, в щелочных [Н+]
< 10"7.В данном случ реакция
среды выр-ся колич-но через концентрацию
моль/л.А можно через отрицательного
десятичного логарифма концентрации
водородных ионов, которое называют
водородным показателем:pH=-lg[H+](у
воды=7,меньше-кислоты) для нейтральной
среды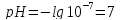 .
Для определения рН используют
кислотно-щелочные индикаторы, которые
представляют собой слабые органические
кислоты и основания, имеющие различную
окраску в диссоциированной и молекулярной
формах. Так, индикатор фенолфталеин
представляет собой слабую органическую
кислоту (общий видHind). В
водном растворе фенолфталеин диссоциирует
по схеме НInd(бесцветный)
= Н++Ind-(малиновый), причем окраска остается
бесцветной , поскольку концентрация
окрашенного иона ничтожно мала. При
добавлении щелочи равновесие сильно
смещается вправо, так как ионы водорода
связываются гидроксид-ионами в
малодиссоциированные молекулы воды.
Поэтому в щелочной среде раствор
приобретает малиновую окраску. При
работе в кислых средах в качестве
индикатора используют слабые органические
основания, диссоциирующие по схемеIndOH(окраскаI)
=Ind+(окраскаII)+OH-. Увеличение
концентрации ионов водорода (повышение
кислотности среды) сдвигает равновесие
вправо за счет связывания ионов ОН-,
и наблюдается изменение цветности
раствора.
.
Для определения рН используют
кислотно-щелочные индикаторы, которые
представляют собой слабые органические
кислоты и основания, имеющие различную
окраску в диссоциированной и молекулярной
формах. Так, индикатор фенолфталеин
представляет собой слабую органическую
кислоту (общий видHind). В
водном растворе фенолфталеин диссоциирует
по схеме НInd(бесцветный)
= Н++Ind-(малиновый), причем окраска остается
бесцветной , поскольку концентрация
окрашенного иона ничтожно мала. При
добавлении щелочи равновесие сильно
смещается вправо, так как ионы водорода
связываются гидроксид-ионами в
малодиссоциированные молекулы воды.
Поэтому в щелочной среде раствор
приобретает малиновую окраску. При
работе в кислых средах в качестве
индикатора используют слабые органические
основания, диссоциирующие по схемеIndOH(окраскаI)
=Ind+(окраскаII)+OH-. Увеличение
концентрации ионов водорода (повышение
кислотности среды) сдвигает равновесие
вправо за счет связывания ионов ОН-,
и наблюдается изменение цветности
раствора.
