
- •2. Марганец и его соединения. Биологическая роль.
- •3. Железо и его соединения. Биологическая роль.
- •4. Ионное произведение воды. Водородный показатель.
- •5. Силы Ван-дер-Вальса.
- •7. Упругость пара над раствором. Законы Рауля.
- •9. Ионная связь.
- •11. Кислородосодержащие кислоты хлора. Соли этих кислот. Биологическая роль.
- •12. Координационная теория Вернера.
- •13. Классификация и изомерия комплексных соединений.
- •15. Кислородосодержащие кислоты серы. Соли этих кислот.
- •16. Понятие о квантовой механике.
- •17. Многоэлектонные атомы и периодический закон.
- •18. Окисли азота.
- •19. Окислительно-восстановительные реакции.
- •20. Аммиак и его свойства.
- •21. Водородные соединения галогенов. 22. Галогеноводородные кислоты.
- •23. Метод молекулярных орбиталей.
- •25. Константа и степень электролитической диссоциации.
- •26. Азотная кислота и ее соли.
- •27. Гибридизация атомных орбиталей.
- •29. Периодичность изменения свойств элементов и их соединений.
- •30. Гидролиз.
- •32. Благородные газы.
- •35. Металлическая связь.
- •38. Современная химическая атомистика.
- •39. Осмос. Осмотическое давление. Закон Вант Гоффа.
- •41. Теория Бора.
- •43. Скорость химических реакций. Химическое равновесие.
- •44. Понятие об активном комплексе и энергии активации.
- •45. Серная кислота
- •46. Растворы. Растворимость как физико-химический прочес (гидратная теория, теория Менделеева).
29. Периодичность изменения свойств элементов и их соединений.
В наст время Периодический закон Д. И. Менделеева «св-ва химх Э, а также формы и св-ва образуемых ими пр в-в и соединений находятся в период зависимости от величины ЗЯ их атомов».1. Атомный радиус (нм).– расстояние от центра ядра атома до максимально наиболее удаленной ЭО.2. Энергия ионизации (I, кДж/моль).– это та энергия, которую необходимо затратить для отрыва от атома наиболее слабо связанного с ним е.→+,↓-.3. Энергия электронного сродства(Еср , кДж/моль)-энергия, которая выделяется при присоединении к атому одного электрона( присоединени 2-го электрона связано с затратой энергии). .→+,↓-.Чем больше энергия сродства, тем сильнее неметалические свойства; тем легче атомы присоединяют электроны.4. Электроотрицательность.– СП-ть атомов притягивать к себе электроны→+,↓-.5)Степень окисления — воображаемый заряд атома элемента в соединении, который определяется из предположения ионного строения вещества.Определение степеней окисления элементов основано на след положениях: 1) ст окисления кислорода принимается равной -2. Искл:Na202, КО3Ь, во фторидах кислорода +OF22) водород +1. Только в солеобраз- ных гидридах типаNaH-1; 3) ст окисления щел ме +1; 4) степень окисления атомов, входящих в состав простых веществ, равна нулю; 5) в любом ионе алгебраическая сумма всех степеней окисления равна заряду иона, а в нейтральных молекулах эта сумма равна нулю.Важность окислительного числа прежде всего заключается в том, что номер группы Периодической системы указывает на высшую положительную степень окисления (характеристическая степень окисления), которую могут иметь элементы данной
Периодически изменяются следующие свойства простых и сложных соединений элементов:
1) строение простых веществ(немол→мол)2) температуры плавления →возрастает,затем уменьшается,что связано с строением пр.в-в.3)Ме.св-ва →-,↓+.4)основные →-,↓+,а кислотные наоборот.
30. Гидролиз.
Реакции гидролиза – реакции обменного взаимодействия ионов соли (и др. в-в) с ионами малодиссоциирующих молекул воды,рез-тат кот. явл-ся малодиссоц,труднораствор,летуч.соединения. Обратная реакции нейтрализации.
В зависимости от природы соли гидролиз протекает по разному. Рассмотрим реакцию гидролиза соли, образованной слабой кислотой и сильным основанием.I.CH3COONa+HOH↔CH3COOH+NaOH;
CH3COO-+Na++HOO↔CH3COOH+Na++OH-;CH3COO-+HOH↔CH3COOH+OH-. Таким образом, соль сильного основания и слабой кислоты гидролизуется с увеличением концентрации гидроксид-ионов в растворе.Равновесие явл-ся обраимым процессом,но в больш.степ смещено к малодиссоц.в-ву.II. Гидролиз соли сильн.к-ты и слаб.основания.Среда-щелочная.Z nCl2+HOH↔ZnOHCl+HCl; Zn+2+2Cl-+HOH↔ZnOH++Cl-+H++Cl-; Zn+2+HOH↔ZnOH++H+2.Соль слабого основания и сильной кислоты гидролизуется с увеличением концентрации ионов водорода.Среда-кислая.Солью слаб кислоты и слаб основанием:CH3COONH4+НОН=CH3COOH+NH3*H2O; CH3COO-+NH4++H2O→CH3COOH+NH3 ∙ H2O
Среда близкая
к нейтральной, но щелочная. Соли,
образованные сильной кислотой и сильным
основанием гидролизу не
подвергаются.Факторы:Усиливает
гидролиз; 1. Температура – при нагревании
процесс идет быстрее;2. разбавление
раствора (концентрация).Ослабление:1.
Понижение температуры.2. Добавление в
раствор или ионов Н+или ионов ОН-.
С количественной точки зрения гидролиз
в разбавленных растворах можно
охарактеризоватьконстантой гидролиза.
Например, при гидролизе ацетат-ионаAc-+HOH↔HAc+OH-константа равновесия имеет вид .
Концентрация недиссоциированных молекул
воды постоянна. Тогда
.
Концентрация недиссоциированных молекул
воды постоянна. Тогда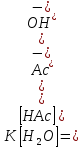 есть также величина постоянная и
представляет собой константу гидролиза.
есть также величина постоянная и
представляет собой константу гидролиза.
