
- •1. Закономірність в атомних спектрах
- •Закономірності в атомних спектрах.
- •Моделі атома Томсона і Резерфорда.
- •Постулати Бора.
- •Досліди Франка і Герца.
- •Правило квантування колових орбіт.
- •Елементарна борівська теорія водневого атома.
- •1. Гіпотеза де Бройля, хвильові властивості мікрочастинок
- •2. Принципи невизначеностей Гейзенберга
- •Гіпотеза де Бройля, хвильові властивості мікрочастинок.
- •Принцип невизначеності Гейзенберга.
- •Фізичний зміст і властивості хвильової функції «псі».
- •Зв'язок рівняння Шредінгера з хвильовим рівнянням.
- •1. Рух вільної мікрочастинки
- •3. Квантова теорія водневого атома
- •Рух вільної мікрочастинки.
- •6.2. Рух мікрочастинки в одновимірній «потенціальній ямі». Тунельний ефект.
- •Квантова теорія водневого атома.
- •1. Спектри лужних металів.
- •4. Рентгенівські спектри.
- •Спектри лужних металів
- •Механічний і магнітний моменти. Нормальний ефект Зеємана
- •Досліди Штерна і Герлаха. Мультиплетність спектрів
- •Рентгенівські спектри
- •Принцип Паулі. Розподіл електронів в атомі по енергетичних рівнях.
- •Досліди Штерна і Герлаха
- •Принцип Паулі. Розподіл електронів в атомі по енергетичних рівнях
- •Періодична система елементів д.І. Менделєєва
- •Комбінаційне розсіювання
- •Оптичні квантові генератори (лазери).
- •Вимушене випромінювання.
6.2. Рух мікрочастинки в одновимірній «потенціальній ямі». Тунельний ефект.
Усякий
зв’язаний стан частинки (електрон в
атомі, вільний електрон в металі, нуклон
в ядрі тощо), тобто стан з від’ємною
потенціальною енергією, можна описати
поняттям потенціальної ями.
Розглянемо
найпростіший випадок, коли частинка
масою m перебуває в одновимірній
прямокутній нескінченно глибокій
потенціальній ямі шириною l. Оскільки
початок відліку потенціальної енергії
можна вибирати довільно, то задачу про
“яму” замінимо задачею про “ящик”,
на дні якого потенціальна енергія
дорівнює нулю, а стінки якого нескінченно
високі. Оператор Гамільтона ![]() для
цього випадку має вигляд
для
цього випадку має вигляд
![]() (6.2.1)
(6.2.1)
де
![]()
Всередині ящика рівняння Шредінгера запишеться як
![]() (6.2.2)
(6.2.2)
Розв’язок
цього рівняння, з врахуванням стандартних
вимог, зокрема,
![]() ,
має вигляд
,
має вигляд
![]() (6.2.3)
(6.2.3)
де n=1,2,3,… – квантове число стану частинки. Енергія частинки в різних квантових станах
![]() (6.2.4)
(6.2.4)
тобто
приймає не довільні, а дискретні значення
Е1,
Е2,
Е3,…
Густина імовірності ![]() залежить від координати частинки, при
цьому, по-різному в кожному квантовому
стані.
Відстань
між сусідніми енергетичними рівнями
залежить від координати частинки, при
цьому, по-різному в кожному квантовому
стані.
Відстань
між сусідніми енергетичними рівнями
![]() (6.2.5)
(6.2.5)
Зокрема,
для електрона в ямі шириною l![]() м,
яка співмірна з розміром атома, отримаємо
м,
яка співмірна з розміром атома, отримаємо
![]() .
В цей же час для макрооб’єктів, коли m
i l – дуже великі, відстань між рівнями
стає зникаюче малою, і тому квантуванням
енергії можна знехтувати. Задача про
частинку в потенціальній ямі скінченної
глибини має дещо складніший розв’язок,
але висновок про квантування енергії
залишається в силі і в цьому випадку.
Спорідненою
до описаної є задача про проходження
частинки через потенціальний бар’єр
шириною l і висотою U0.
Якщо частинка класична, то вона пролітає
над бар’єром, коли Е > U0,
і відбивається від нього, коли Е < U0,
бо проникнення під бар’єр означало б,
що її кінетична енергія від’ємна.
Для
квантово-механічної мікрочастинки
розв’язок рівняння Шредінгера дає, що
хвильові функції в усіх трьох областях
.
В цей же час для макрооб’єктів, коли m
i l – дуже великі, відстань між рівнями
стає зникаюче малою, і тому квантуванням
енергії можна знехтувати. Задача про
частинку в потенціальній ямі скінченної
глибини має дещо складніший розв’язок,
але висновок про квантування енергії
залишається в силі і в цьому випадку.
Спорідненою
до описаної є задача про проходження
частинки через потенціальний бар’єр
шириною l і висотою U0.
Якщо частинка класична, то вона пролітає
над бар’єром, коли Е > U0,
і відбивається від нього, коли Е < U0,
бо проникнення під бар’єр означало б,
що її кінетична енергія від’ємна.
Для
квантово-механічної мікрочастинки
розв’язок рівняння Шредінгера дає, що
хвильові функції в усіх трьох областях![]() відмінні від нуля, тобто мікрочастинка
проникає під бар’єр і за бар’єр. Це
явище називається тунелюванням.
Від’ємні значення кінетичної енергії
в області ІІ не суттєві, бо в квантовій
механіці, в силу дії співвідношення
Гайзенберга, кінетична енергія
відмінні від нуля, тобто мікрочастинка
проникає під бар’єр і за бар’єр. Це
явище називається тунелюванням.
Від’ємні значення кінетичної енергії
в області ІІ не суттєві, бо в квантовій
механіці, в силу дії співвідношення
Гайзенберга, кінетична енергія ![]() ,
як і потенціальна енергія U(x), не є точно
визначеними. Прозорість бар’єру
,
як і потенціальна енергія U(x), не є точно
визначеними. Прозорість бар’єру ![]() тим більша, чим менша його ширина і
висота, а також, чим менша маса частинки,
тобто ефект тунелювання помітний лише
в мікросвіті.
тим більша, чим менша його ширина і
висота, а також, чим менша маса частинки,
тобто ефект тунелювання помітний лише
в мікросвіті.
-
Квантова теорія водневого атома.
Атом водню в квантовій механіці. Квантові числа.
Бор, використовуючи свої постулати, вирішив задачу про енергетичні рівні електрона в системі водневого атома. В квантовій механіці ці результати можуть бути отримані без використання постулатів Бора.
Розглянемо
рух електрона в кулонівському полі ядра
Ze, тобто вирішимо задачу про електрон,
який має потенціальну енергію ![]() ,
де r – відстані між електроном і ядром.
Стан електрона в атомі водню описується
хвильовою функцією
,
де r – відстані між електроном і ядром.
Стан електрона в атомі водню описується
хвильовою функцією ![]() ,
яка задовольняє стаціонарну форму
рівняння Шредінгера ( лекція 5)
,
яка задовольняє стаціонарну форму
рівняння Шредінгера ( лекція 5)
![]() (6.3.1)
(6.3.1)
де
Е – значення повної енергії електрона
в атомі, яке необхідно відшукати при
умові, що ![]() задовольняє потреби скінченності,
однозначності і неперервності.
задовольняє потреби скінченності,
однозначності і неперервності.
В теорії диференціальних рівнянь доводиться, що рівняння такого вигляду, як рівняння Шредінгера, має рішення, яке задовольняє сформульовані вище вимоги, не при будь-яких значеннях параметра Е, а лише при деяких вибраних визначеннях. Ці вибрані значення називаються значеннями параметра, а відповідні їм рішення – власними функціями задачі.
Так
як поле, що розглядається є
центральносиметричним, то для рішення
цієї задачі використовують сферичну
систему координат. Вирішуючи це рівняння
в сферичних координатах, можна отримати,
що при Е ![]() 0, тобто в умовах, коли електрон «зв’язаний»
в атомі (випадок Е > 0 відповідає
електрону, який пролітає поблизу ядра
і віддаляється знову в нескінченність),
його рух має бути періодичним, а значення
Е – повної енергії – квантованими.
Значення енергії, які може мати в даному
випадку електрон в атомі, визначається
виразом
0, тобто в умовах, коли електрон «зв’язаний»
в атомі (випадок Е > 0 відповідає
електрону, який пролітає поблизу ядра
і віддаляється знову в нескінченність),
його рух має бути періодичним, а значення
Е – повної енергії – квантованими.
Значення енергії, які може мати в даному
випадку електрон в атомі, визначається
виразом
![]() (6.3.2)
(6.3.2)
Порівнявши рівняння за Бором з (6.3.2), воно показує, що квантова механіка приводить до таких же значень енергії атома водню, які отримувалися і в теорії Бора. Але в квантовій механіці ці значення отримуються логічним шляхом із припущення про те, що рух мікрочастинок описується рівнянням Шредінгера. Бору ж для отримання такого результату прийшлося вводити додаткові припущення.
Квантове число n, яке визначається в виразі (6.3.2), співпадає з головним квантовим числом, що вводиться в теорії Бора. Таким чином, енергетичні рівні електрона для атома водню залежать тільки від головного квантового числа.
Із вирішення рівняння Шредінгера слідує ще один важливий результат, а саме: момент імпульсу електрона (момент кількості руху) в атомі кантується по формулі
![]() (6.3.3)
(6.3.3)
де
![]() = 0, 1, 2 …., (n-1)
– орбітальне квантове число, яке може
приймати n різних значень.
= 0, 1, 2 …., (n-1)
– орбітальне квантове число, яке може
приймати n різних значень.
Виявляється,
що власні функції рівняння Шредінгера
мають три цілочисельних параметра: два
з них ми вже назвали (n і l), третім
являється ще одне квантове число, яке
позначається m (називається магнітне
квантове число). Магнітне квантове число
може приймати значення ![]() тобто всього
тобто всього ![]() різних значень. В квантовій механіці
доводиться, що магнітне квантове число
m визначає величину проекції моменту
імпульсу на заданий напрямок. Заданий
напрямок (будемо його позначати z)
називається напрямок, визначений
фізично, шляхом створення, наприклад,
магнітного або електричного поля. Таким
чином, проекція моменту імпульсу на
заданий напрямок дорівнює
різних значень. В квантовій механіці
доводиться, що магнітне квантове число
m визначає величину проекції моменту
імпульсу на заданий напрямок. Заданий
напрямок (будемо його позначати z)
називається напрямок, визначений
фізично, шляхом створення, наприклад,
магнітного або електричного поля. Таким
чином, проекція моменту імпульсу на
заданий напрямок дорівнює
![]() (6.3.4)
(6.3.4)
Із виразів (6.3.3) і (6.3.4) витікає, що момент імпульсу електрона в атомі і проекція цього моменту являються, як і енергія, квантованими величинами.
Із
розгляду трьох квантових чисел ![]() слідує, що кожному
слідує, що кожному ![]() (крім
(крім
![]() )
відповідає декілька хвильових функцій
)
відповідає декілька хвильових функцій
![]() ,
які відрізняються значенням квантових
чисел
,
які відрізняються значенням квантових
чисел ![]() .
Це, в свою чергу, означає, що атом водню
може мати одне і те ж значення енергії,
знаходячись в декількох різних станах.
Стани з однаковою енергією називаються
виродженими, а число різних станів з
одним значенням енергії називається
кратністю виродження.
.
Це, в свою чергу, означає, що атом водню
може мати одне і те ж значення енергії,
знаходячись в декількох різних станах.
Стани з однаковою енергією називаються
виродженими, а число різних станів з
одним значенням енергії називається
кратністю виродження.
Для
водню кратність виродження рівнів можна
обчислити, виходячи з можливих значень
![]() .
Кожному із n
значень квантового числа
.
Кожному із n
значень квантового числа ![]() відповідає
відповідає ![]() значень квантового числа
значень квантового числа ![]() .
Внаслідок чого, кратність виродження
в даному випадку:
.
Внаслідок чого, кратність виродження
в даному випадку:
![]() (6.3.5)
(6.3.5)
тобто
кожен рівень енергії водневого атома
має виродження кратності ![]() .
.
Стани
електрона, який має різні значення
орбітального квантового числа ![]() ,
в атомній фізиці прийнято позначати і
називати як в спектроскопії:
,
в атомній фізиці прийнято позначати і
називати як в спектроскопії:
![]() - s-стан (електрон, що знаходиться в даному
стані називається s-електроном),
- s-стан (електрон, що знаходиться в даному
стані називається s-електроном),
![]() - p-стан,
- p-стан,
![]() - d-стан,
- d-стан,
![]() - f-стан і так далі.
- f-стан і так далі.
Значення
головного квантового числа вказується
перед умовним позначенням орбітального
квантового числа ![]() (наприклад, електрон в стані n – 4 і
(наприклад, електрон в стані n – 4 і ![]() позначається символом 4d). Так як
позначається символом 4d). Так як ![]() завжди менше n, то можливі наступні стани
електрона:
завжди менше n, то можливі наступні стани
електрона:
1s,
2s, 2p,
3s, 3p, 3d,
4s, 4p, 4d, 4f
і так далі.
Відомо,
що випускання і поглинання світла
відбувається при переході електрона з
одного рівня на інший. В квантовій
механіці доводиться, що можливі тільки
такі переходи, при яких квантове число
![]() змінюється на одиницю:
змінюється на одиницю:
![]() .
(6.3.6)
.
(6.3.6)
Співвідношення (6.3.6) називається правилом відбору, воно слідує із закону збереження моменту імпульсу.
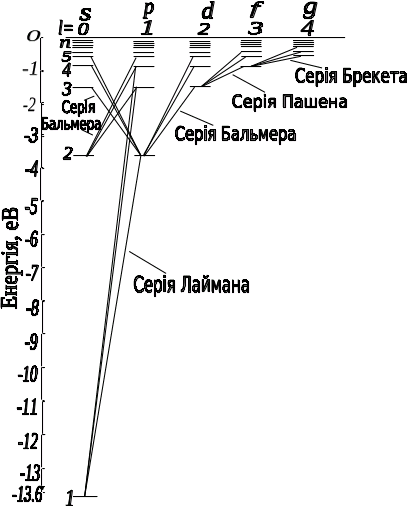
Рис 6.3.1
На (рис. 6.3.1) для атома водню показані переходи, дозволені правилом відбору (6.3.6). Для серії Лаймана можна записати:
np![]() (n
= 2, 3, ….);
(n
= 2, 3, ….);
серії Бальмера відповідають переходи:
![]()
Стан 1s є основним станом атома водню. В цьому стані атом має мінімальну енергію. Для того щоб перевести атом із основного стану в збуджений, йому необхідно надати енергію, наприклад, за рахунок поглинання атомами фотона. Фотон же при поглинанні його атомом зникає, передаючи атому всю свою енергію. Так як фотон нероздільний, то атом не може поглинути частину фотона, а тому атом може поглинати тільки ті фотони, енергія яких відповідає різниці енергій двох його рівнів. Атом, який поглинає, зазвичай знаходиться в основному стані, тому спектр поглинання атома водню повинен складатися із ліній, що відповідають переходам
![]()
що знаходиться в повній відповідності з дослідом.
Таким чином, крім того, що рівняння Шредінгера дозволяє визначити параметри, які характеризують стаціонарні стани Е, квантові числа, воно дозволяє також розглянути імовірність процесів випромінювання і поглинання, тобто ймовірність переходів атома із одного стаціонарного стану в інший.
Контрольні питання:
1. Записати рівняння Шредінгера для стаціонарних станів для вільної частинки.
2. Чому всі положення вільної частинки в просторі є рівно імовірними?
3. Який стан частинки можна описати поняттям потенціальної ями?
4. Яке явище називається тунелюванням?
5. Назвати три цілочисельних параметра власних функцій рівняння Шредінгера.
6.Як називаються стани електрона з однаковою енергією? Як називається число різних станів з одним значенням енергії?
7. Які переходи відповідають серії Бальмера?
8. В якому стані атом має мінімальну енергію?
9. Що слід зробити щоб перевести атом із основного стану в збуджений?
Рекомендований до перегляду відеоматеріал після ознайомленням з лекційним матеріалом:
-
https://www.youtube.com/watch?v=gWHbMrORkS0
(лекція-квантова теорія водневого атома)
Література:
-
Навчальний посібник для студентів вищих технічних і педагогічних закладів освіти / Кучерук І. М., Горбачук І. Т.; за ред. Кучерука І. М. - К.: Техніка, 1999.Том 3: Оптика. Квантова фізика. - 520 с
-
Курс общей физики. Т.2. Электричество и магнетизм. Волны. Оптика. Савельев И.В. 3-е изд., испр.. - М.: Наука, Гл. ред. физ-мат. лит., 1988.— 496с.
Лекція 7
Тема: "Спектри багатоелектронних атомів"
Питання лекції:
