
Кишкун А.А
.pdf
222 ■ Глава 4
крови, ферментный состав которой относительно постоянен. Нормальная активность ферментов в сыворотке крови отражает соотношение между биосинтезом и высвобождением ферментов (при обычном обновлении клеток), а также их клиренсом из кровотока. Повышение скорости обновления ферментов, повреждения клеток обычно приводят к повышению активности ферментов в сыворотке крови. В сыворотке крови выделяют три группы ферментов: клеточные, секреторные и экскреторные.
Клеточные ферменты в зависимости от локализации в тканях делят на две группы:
■неспецифические ферменты, которые катализируют общие для всех тканей реакции обмена и находятся в большинстве органов и тканей;
■органоспецифические или индикаторные ферменты, специфичные
только для определённого типа тканей.
В сыворотке крови активность клеточных ферментов низка или вообще отсутствует. При патологических процессах активность ферментов этой группы в сыворотке крови зависит от скорости высвобождения из клеток, которая в свою очередь определяется скоростью и степенью их повреждения.
Секреторные ферменты (церулоплазмин, псевдохолинэстераза, липопротеиновая липаза) поступают непосредственно в плазму крови и выполняют в ней специфические функции. Эти ферменты синтезируются в печени
ипостоянно высвобождаются в плазму. Их активность в сыворотке крови выше, чем в клетках или тканях. В клинической практике они представляют интерес, когда их активность в сыворотке крови становится ниже нормы за счёт нарушения функции печени.
Экскреторные ферменты образуются органами пищеварительной систе-
мы (поджелудочной железой, слизистой оболочкой кишечника, печенью, эндотелием жёлчных путей). К ним относятся α-амилаза, липаза, щелочная фосфатаза и др. В норме их активность в сыворотке крови низка
ипостоянна. Однако при патологии, когда блокирован любой из обычных путей экскреции, активность этих ферментов в сыворотке крови значительно увеличивается.
Измеряемая активность ферментов может быть обусловлена наличием весьма близких по свойствам, но несколько отличающихся друг от друга молекулярных форм ферментов. Эти различные формы получили название изоферментов. Исследование изоферментов в клинической практике представляет интерес, когда отдельные изоферменты образуются в разных тканях (например, в сердце и печени преобладают различные изоферменты ЛДГ).
Для количественной оценки активности ферментов Комиссия по ферментам Международного биохимического союза рекомендовала стандартную международную единицу (МЕ). За единицу активности любого фермента принимают то его количество, которое в оптимальных условиях катализирует превращение 1 мкмоль субстрата в 1 минуту (мкмоль/мин).
Об активности фермента судят по скорости катализируемой реакции при определённых температуре и рН среды, концентрации субстрата. Поэтому при определении активности ферментов необходимо строго соблюдать одни и те же условия.
Ферментативная реакция чувствительна к изменениям температур. Обычно её принято проводить при температуре, лежащей в пределах

Биохимические исследования ■ 223
25−40 °C, однако при разной температуре оптимальные значения рН, концентрации буфера, субстрата и других параметров различны. Максимальную активность большинства ферментов в организме человека наблюдают при температуре приблизительно 37 °C. Поэтому в целях международной стандартизации измерения активности ферментов проводят при данной температуре. Ниже нормальные величины активности ферментов приведены для температуры 37 °C.
Исследование ферментов применяют в клинической практике для решения различных задач: установления диагноза, проведения дифференциальной диагностики, оценки динамики течения болезни, определения эффективности терапии, степени выздоровления и прогноза заболевания. Известно три типа изменений ферментов при патологии: гиперферментемия — повышение активности ферментов по сравнению с нормой, гипоферментемия — её снижение, дисферментемия — появление в крови ферментов, в норме не обнаруживаемых.
Аспартат аминотрансфераза в сыворотке крови
Референтные величины активности АСТ в сыворотке крови — 10−30 МЕ/л. АСТ катализирует перенос аминогруппы с аспарагиновой кислоты (аминокислота) на α-кетоглутаровую кислоту (кетокислота). АСТ широко распространена в тканях человека (сердце, печень, скелетная мускулатура, почки, поджелудочная железа, легкие и др.). Существуют митохондриальный и цитоплазматический изоферменты АСТ. В норме сыворотка крови
содержит только цитоплазматический (цитозольный) изофермент АСТ. Повышение активности АСТ в крови наблюдают при целом ряде заболева-
ний, особенно при поражении органов и тканей, богатых данным ферментом. Наиболее резкие изменения в активности АСТ возникают при поражении сердечной мышцы. Активность фермента у 93−98% больных ИМ повышена.
В клинической практике нашло широкое применение одновременное определение в крови активности АСТ и АЛТ; оно несёт гораздо больше клинической информации о локализации и глубине поражения, активности патологического процесса; позволяет прогнозировать исход болезни.
При ИМ АСТ повышается в сыворотке через 6−8 ч, максимальной активности она достигает через 24−36 ч и снижается до нормального уровня к 5−6-му дню. Расширение зоны ИМ приводит к появлению второго цикла повышения активности. Степень повышения активности АСТ отражает массу миокарда, вовлечённого в патологический процесс. Иногда активность АСТ повышается ещё до появления электрокардиографических признаков ИМ, а отсутствие снижения её уровня после 3−4-го дня заболевания прогностически неблагоприятно. При ИМ активность АСТ в крови может увеличиваться в 2−20 раз.
При стенокардии активность АСТ, как правило, остаётся в пределах нормы. Однако ряд авторов указывает на повышение АСТ при тяжёлой форме коронарной недостаточности в первые 24 ч после приступа и нормализацию на 2-й, реже 3-й день после приступа, а также при длительных приступах пароксизмальной тахикардии.
АСТ повышается также при остром гепатите и других тяжёлых поражениях гепатоцитов. Умеренное увеличение наблюдают при механической желтухе, у больных с метастазами в печень и циррозом. Коэффициент де
4 Глава ■ 224
Рис. 4-4. Алгоритм принятия клинических решений при установлении этиологии поражения печени по значениям активности АСТ

Биохимические исследования ■ 225
Ритиса, то есть отношение АСТ/АЛТ, в норме равное 1,33, при заболеваниях печени ниже этой величины, а при заболеваниях сердца — выше.
Значения уровня активности АСТ (пороги для принятия клинических решений) при установлении клинического диагноза поражения печени представлены на рис. 4-4. Ряд показателей представляет собой множители, на которые умножают значение верхнего референтного предела для АСТ.
Аланин аминотрансфераза в сыворотке крови
Референтные величины активности АЛТ в сыворотке крови — 7−40 МЕ/л. АЛТ катализирует перенос аминогруппы с аланина (аминокислота) на α-кетоглутаровую кислоту (кетокислота). АЛТ содержится в скелетной мускулатуре, печени, сердце. В сердечной мышце её значительно меньше, чем АСТ. В меньших количествах АЛТ обнаружена также в поджелудочной железе, селезёнке, лёгких. Самых больших концентраций АЛТ достигает
впечени.
Повышение активности аминотрансфераз (АСТ и АЛТ) в 1,5−5 раз по
сравнению с верхней границей нормы рассматривают как умеренную гиперферментемию, в 6−10 раз — как гиперферментемию средней степени, более чем в 10 раз — как высокую. Степень подъёма активности аминотрансфераз свидетельствует о выраженности цитолитического синдрома, но не указывает прямо на глубину нарушений собственно функции органа.
При ИМ повышение активности АЛТ в сыворотке крови выявляют в 50−70% случаев, чаще при обширных некрозах сердечной мышцы. Наибольшее увеличение активности АЛТ выявляют в острой фазе — в среднем 130−150% нормы, что заметно уступает таковому АСТ — в среднем 450−500% нормы.
При заболеваниях печени в первую очередь и наиболее значительно по сравнению с АСТ изменяется активность АЛТ. При остром гепатите, независимо от его этиологии, активность аминотрансфераз повышается у всех больных. Особенно изменяется активность АЛТ, содержащейся в цитоплазме, вследствие её быстрого выхода из клетки и поступления в кровяное русло, поэтому определение активности АЛТ — более чувствительный тест для ранней диагностики острого гепатита, чем АСТ. Период полураспада АЛТ приблизительно 50 ч. АСТ расположена преимущественно
вмитохондриях, период её полураспада — 20 ч, поэтому её активность
повышается при более тяжёлых повреждениях гепатоцита. Активность АЛТ и АСТ повышается за 10−15 дней до появления желтухи при гепатите А, и за много недель при гепатите В (активность указанных ферментов повышает одновременно, но АЛТ — в значительно большей степени). При ти-
пичном течении вирусного гепатита активность АЛТ достигает максимума на 2−3-й неделе заболевания. При благоприятном его течении активность АЛТ нормализуется через 30−40 сут, АСТ — через 25−35 сут. Повторное или прогрессирующее повышение активности аминотрансфераз свидетельствует о новом некрозе или рецидиве болезни. Удлинение периода повышенной активности аминотрансфераз часто является неблагоприятным признаком, так как может свидетельствовать о переходе острого процесса
вхронический.
Вострый период вирусного гепатита при всех формах, кроме тяжёлой, коэффициент де Ритиса колеблется от 0,55 до 0,65, при тяжёлом течении этот коэффициент составляет в среднем 0,83, что отражает более значитель-

226 ■ Глава 4
ное повышение активности АСТ. В дифференциально-диагностическом отношении имеет некоторое значение то, что при алкогольных поражениях печени, в противоположность вирусным, характерно преимущественное повышение активности АСТ (коэффициента де Ритиса — более 2).
Для хронических гепатитов характерна умеренная и средняя гиперферментемия.
При латентных формах цирроза печени повышения активности ферментов, как правило, не наблюдают. При активных формах стойкий, хотя
инезначительный подъём активности аминотрансфераз выявляют в 74− 77% случаев.
Заслуживает внимания билирубин-аминотрансферазная диссоциация, то есть случаи выраженной гипербилирубинемии (преимущественно за счёт прямого билирубина) и низкой активности аминотрансфераз. Данную диссоциацию наблюдают при подпечёночной желтухе со стабильной жёлчной гипертензией, острой печёночной недостаточности. Активность АСТ
иАЛТ, а также щелочной фосфатазы повышается при разрешении хронической сердечной недостаточности (пик обычно на 3−4 сут).
Повышение активности АЛТ и АСТ может быть выявлено и у практически здоровых носителей поверхностного антигена гепатита В, что указывает на наличие внешне бессимптомных активных процессов в печени.
Общая лактат дегидрогеназа в сыворотке крови
Референтные величины активности общей ЛДГ в сыворотке крови — 208−378 МЕ/л.
ЛДГ — гликолитический цинксодержащий фермент, обратимо катализирующий окисление L-лактата в пировиноградную кислоту, широко распространён в организме человека. Наибольшая активность ЛДГ обнаружена в почках, сердечной мышце, скелетной мускулатуре и печени. ЛДГ содержится не только в сыворотке, но и в значительном количестве в эритроцитах, поэтому сыворотка для исследования должна быть без следов гемолиза. Большинство органов и тканей человека содержит пять изоферментов ЛДГ. Характер изоферментного спектра ЛДГ и тип обмена веществ в ткани коррелируют между собой. В тканях с преимущественно аэробным обменом веществ (сердце, мозг, почки) преобладают изоферменты ЛДГ1 и ЛДГ2. В тканях с выраженным анаэробным обменом веществ (печень, скелетная мускулатура) преобладают изоферменты ЛДГ4 и ЛДГ5. В сыворотке крови здорового человека постоянно обнаруживают все пять изоферментов ЛДГ. Прослеживается закономерность в отношении активности изоферментов ЛДГ: активность ЛДГ2>ЛДГ1>ЛДГ3>ЛДГ4>ЛДГ5. Повреждение того или иного органа изменяет изоферментный спектр сыворотки крови, причём эти изменения обусловлены спецификой изоферментного состава повреждённого органа.
Повышенную активность ЛДГ в физиологических условиях наблюдают у беременных, новорождённых, у лиц после интенсивных физических нагрузок.
Повышение активности ЛДГ при ИМ отмечают спустя 8−10 ч после его начала. Спустя 48−72 ч достигается максимум активности (повышение обычно в 2−4 раза), она остаётся увеличенной в течение 10 сут. Эти сроки могут варьировать в зависимости от величины участка повреждённой мыш-

Биохимические исследования ■ 227
цы сердца. Увеличение активности общей ЛДГ у больных ИМ происходит за счёт резкого повышения ЛДГ1 и частично ЛДГ2. У больных стенокардией повышения активности ЛДГ не наблюдают, что позволяет применять определение ЛДГ в пределах 2−3 сут после ангинозного приступа как высоконадёжный критерий отсутствия поражения сердечной мышцы.
Умеренное увеличение активности общей ЛДГ наблюдают у большинства больных с острой коронарной недостаточностью (без ИМ), миокардитом, с хронической сердечной недостаточностью, с застойными явлениями
впечени. У больных с сердечными аритмиями активность ЛДГ обычно
внорме, но при применении электроимпульсной терапии иногда происходит её увеличение.
Источником увеличения активности ЛДГ может быть лёгочная ткань при эмболии и инфаркте лёгких. Сочетание нормальной активности АСТ, повышенной активности ЛДГ и увеличения концентрации билирубина может служить в качестве диагностической триады лёгочной эмболии и для дифференциации её от ИМ. При пневмониях активность фермента иногда может не повышаться.
При миопатиях (мышечные дистрофии, травматические повреждения мышц, воспалительные процессы, расстройства, связанные с эндокринными и метаболическими заболеваниями) наблюдают увеличение активности ЛДГ; при нейрогенных заболеваниях мышц активность ЛДГ не повышается.
При остром вирусном гепатите активность ЛДГ в сыворотке крови увеличивается в первые дни желтушного периода; при лёгкой и среднетяжёлой формах заболевания довольно быстро возвращается к нормальному уровню. Тяжёлые формы вирусного гепатита, и особенно развитие печёночной недостаточности, сопровождаются выраженным и более длительным повышением ЛДГ.
При механической желтухе на первых стадиях закупорки жёлчных протоков активность ЛДГ в норме, на более поздних стадиях наблюдают подъём активности ЛДГ вследствие вторичных повреждений печени.
При карциномах печени или метастазах рака в печень может иметь место подъём активности ЛДГ.
Встадии ремиссии при хроническом гепатите и циррозе печени активность ЛДГ в крови остаётся в пределах нормы или слегка повышена. При обострении процесса отмечают повышение активности фермента.
Повышение активности ЛДГ характерно для мегалобластической и гемолитической анемий, поэтому её определение используют для дифференциальной диагностики болезни Жильбера (ЛДГ в норме) и хронической гемолитической анемии (ЛДГ повышена).
Активность ЛДГ повышается при острых и обострении хронических заболеваний почек; при хронических почечных заболеваниях, ассоциированных с уремией, она может быть нормальной, но часто возрастает после гемодиализа, что обусловлено удалением ингибиторов фермента во время этой процедуры.
Щелочная фосфатаза в сыворотке крови
Щелочная фосфатаза широко распространена в тканях человека, особенно в слизистой оболочке кишечника, остеобластах, стенках жёлчных протоков печени, плаценте и лактирующей молочной железе. Она катали-

228 ■ Глава 4
зирует отщепление фосфорной кислоты от её органических соединений; её название связано с тем, что оптимальная рН данного фермента составляет 8,6−10,1. Фермент расположен на клеточной мембране и принимает участие в транспорте фосфора. Референтные величины активности щелочной фосфатазы представлены в табл. 4-28. Для диагностических целей чаще всего проводят определение активности костной и печёночной форм щелочной фосфатазы.
Таблица 4-28. Референтные величины активности щелочной фосфатазы в сыворотке (реакция с фенилфосфатом)
|
Возраст |
Общая, МЕ/л |
Костная,% |
|
|
|
|
Новорождённые |
35−106 |
|
|
1 |
месяц |
71−213 |
85 |
3 |
года |
71−142 |
85 |
10 лет |
106−213 |
85 |
|
Взрослые до 31 года |
39−92 |
60 |
|
Взрослые старше 31 года |
39−117 |
40 |
|
Костную щелочную фосфатазу продуцируют остеобласты — крупные одноядерные клетки, лежащими на поверхности костного матрикса в местах интенсивного формирования кости. Видимо, благодаря внеклеточному расположению фермента в процессе кальцификации можно проследить прямую связь между заболеванием кости и активностью фермента в сыворотке крови. У детей щелочная фосфатаза повышена до периода полового созревания. Увеличение активности щелочной фосфатазы сопровождает рахит любой этиологии, болезнь Педжета, костные изменения, связанные с гиперпаратиреозом. Быстро увеличивается активность фермента при остеогенной саркоме, метастазах рака в кости, миеломной болезни, лимфогранулематозе с поражением костей.
Активность печёночной формы фосфатазы наиболее часто повышается вследствие повреждения или деструкции гепатоцитов (печёночноклеточный механизм) или нарушения транспорта жёлчи (холестатический механизм). Печёночноклеточный механизм повышения активности щелочной фосфатазы играет ведущую роль при вирусных и аутоиммунных гепатитах, токсических и лекарственных повреждениях печени. Отток жёлчи нарушается вследствие внепечёночной обструкции жёлчных протоков (например, камнем или при развитии послеоперационной стриктуры), сужения внутрипечёночных протоков (например, при первичном склерозирующем холангите), повреждения жёлчных протоков (например, при первичном билиарном циррозе печени) или нарушения транспорта жёлчи на уровне мелких жёлчных протоков (при применении ряда ЛС, например хлорпромазина). В ряде случаев активность щелочной фосфатазы повышается вследствие одновременного действия обоих механизмов повреждения. Повышение активности щелочной фосфатазы при повреждении печени происходит вследствие высвобождения её из гепатоцитов. Активность щелочной фосфатазы при вирусном гепатите, в противоположность аминотрансферазам, остаётся нормальной или повышается незначительно. Увеличение активности щелочной фосфатазы выявляют и у желтушных больных с циррозом

Биохимические исследования ■ 229
печени (в трети случаев). Приблизительно у половины больных инфекционным мононуклеозом на первой неделе заболевания также отмечают повышение активности щелочной фосфатазы. Значительное увеличение активности щелочной фосфатазы наблюдают при холестазе. Внепечёночная закупорка жёлчных протоков сопровождается резким увеличением активности фермента. Повышение активности щелочной фосфатазы наблюдают у 90% больных первичным раком печени и при метастазах в печень. Резко возрастает её активность при отравлениях алкоголем на фоне алкоголизма. Она может повышаться при приёме ЛС, обладающих гепатотоксическим эффектом (тетрациклин, парацетамол, меркаптопурин, салицилаты
идр.). Холестатическая желтуха и, соответственно, повышение активности щелочной фосфатазы возможны у женщин, принимающих пероральные контрацептивы, содержащие эстрогены и прогестерон. По данным разных авторов, лишь приблизительно у 65% госпитализированных больных высокая активность щелочной фосфатазы обусловлена заболеваниями печени.
Очень высокую активность фермента наблюдают у женщин с преэклампсией, что связано с повреждениями плаценты. Пониженная активность щелочной фосфатазы у беременных может свидетельствовать о недостаточности развития плаценты.
Помимо названных причин, повышение активности щелочной фосфатазы выявляется при следующих заболеваниях и состояниях: повышенном метаболизме в костной ткани (при заживлении переломов), первичном
ивторичном гиперпаратиреозе, остеомаляции, почечном рахите, цитомегаловирусной инфекции (ЦМВ-инфекции) у детей, сепсисе, язвенном колите, регионарном илеите, кишечных бактериальных инфекциях, тиреотоксикозе. Это обусловлено тем, что щелочная фосфатаза вырабатывается не только в печени, но и в других органах — костях, кишечнике.
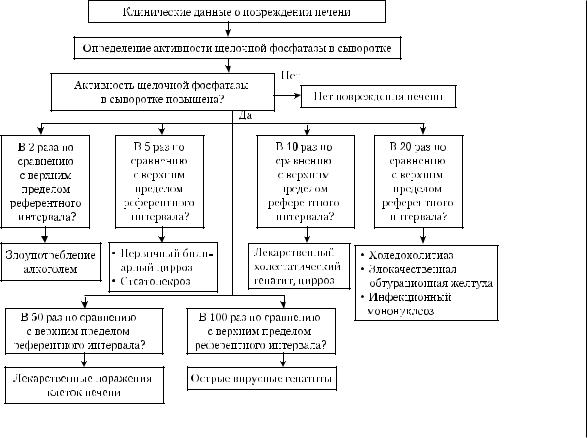
Значения активности щелочной фосфатазы (пороги для принятия клинических решений) при установлении клинического диагноза поражения печени представлены на рис. 4-5 [Меньшиков В.В., 2002]. Ряд значений представляет собой множители, на которые умножают значение верхнего референтного предела для щелочной фосфатазы.
Снижение активности фермента отмечают при гипотиреозе, цинге, выраженной анемии, квашиоркоре, гипофосфатемии.
γ-Глутамил транспептидаза в сыворотке крови
Референтные величины активности γ-глутамил транспептидазы (ГГТП)
всыворотке крови: у мужчин — 10,4−33,8 МЕ/л; у женщин — 8,8−22 МЕ/л. ГГТП — мембранный фермент, состоящий из гидрофильного и гидро-
фобного фрагментов, молекулярная масса которого колеблется от 90 000 до 120 000. В значительных концентрациях ГГТП обнаружена в печени, поджелудочной железе, почках и предстательной железе (поэтому у мужчин активность ГГТП в сыворотке крови приблизительно на 50% выше, чем у женщин). В других клетках тканей ГГТП содержится в небольших количествах (исключая кардиомиоциты и миоциты). Небольшая часть фермента находится в цитозоле, а большая часть связана с мембранами микросом и цитоплазматической мембраной клеток. В основном активность ГГТП высока на мембранах клеток, обладающих высокой секреторной или поглотительной способностью, таких как эпителиальные клетки желчевыво-

4 Глава ■ 230
Рис. 4-5. Алгоритм для принятия клинических решений при установлении этиологии поражения печени по значениям активности щелочной фосфатазы

Биохимические исследования ■ 231
дящих путей, клетки проксимальных канальцев почки, ацинарная ткань поджелудочной железы и её протоки, щёточная каёмка клеток кишечника. ГГТП легко образует комплексы с ЛПВП и ЛПНП, при этом ЛПВП связываются с ГГТП преимущественно в интактной печени, а ЛПНП — при печёночных желтухах. Время полужизни в сыворотке крови ГГТП, связанной с ЛПВП, — 20 ч, а растворимой формы ГГТП — 9 ч.
Повышение активности ГГТП в сыворотке крови может быть обусловлено следующими причинами.
■Усилением синтеза в результате активации ферментов, обеспечивающих этот процесс, алкоголем и ЛС.
■Повреждением клеточных мембран под действием токсических агентов, при ишемии и инфекционном поражении печени.
■Освобождением фермента от связи с клеточными мембранами в результате детергентного действия поверхностно-активных жёлчных кислот при всех видах холестаза.
Изменение активности ГГТП в сыворотке крови имеет большое диагностическое значение при заболеваниях печени и гепатобилиарного тракта. Этот фермент более чувствителен к нарушениям в клетках печени, чем АЛТ, АСТ, щелочная фосфатаза, глутамат дегидрогеназа (ГлДГ) и т.д. Нормальная активность этого фермента при костных заболеваниях позволяет установить источник повышения активности щелочной фосфатазы.
Особенно чувствительна ГГТП к влиянию на печень длительного потребления алкоголя. У лиц, злоупотребляющих алкоголем, активность ГГТП в сыворотке крови коррелирует с количеством принимаемого алкоголя. Тест особенно ценен для контроля лечения алкоголизма. Прекращение приёма алкоголя снижает активность фермента приблизительно на 50% в течение 10 дней.
Определение активности ГГТП используют для установления гепатотоксичности; она повышается в 90% случаев заболеваний печени. В большинстве случаев у таких больных в крови одновременно повышается активность и трансаминаз. Изолированное повышение активности ГГТП наблюдают у 6−20% больных с патологией гепатобилиарной системы. Повышение активности ГГТП более чем в 3 раза вызывают антиконвульсанты, жировая дистрофия печени и сердечная недостаточность.
При острых гепатитах активность ГГТП повышается раньше, чем активность АСТ и АЛТ. На высоте заболевания активность ГГТП ниже (повышена в 2−5 раз), чем активность аминотрансфераз, и нормализуется значительно медленнее. Это позволяет использовать ГГТП для контроля за выздоровлением больного.
Наиболее высокую активность ГГТП (в 5−30 раз выше референтного интервала) наблюдают при внутри- и внепечёночном холестазе. Несколько меньшие значения активности фермента регистрируют при первичных опухолях печени. При злокачественных опухолях другой локализации постепенное увеличение активности ГГТП указывает на наличие метастазов в печень. Активность ГГТП может быть использована в качестве маркёра рака поджелудочной и предстательной железы, так как отражает ремиссии и рецидивы.
Необходимо еще раз заметить, что ГГТП многозначна в диагностическом отношении. По крайней мере 5 процессов повышают её активность: цитолиз, холестаз, интоксикация алкоголем, опухолевый рост в печени,
