
- •3. Фактор эквивалентности. Эквивалентные массы и эквивалентные объемы.
- •3.1Фактор эквивалентности химического элемента х в его соединениях равен:
- •3.2.Фактор эквивалентности вещества х, участвующего в окислительно-восстановительном процессе, равен:
- •3.3.Фактор эквивалентности вещества х, участвующего в ионообменном процессе, равен:
- •5.Применение закона эквивалентов.
- •1. Состав атома
- •Характеристики основных частиц, составляющих атом
- •3. Ядерные реакции
- •5. Атомные орбитали. Квантовые числа..
- •6. Законы, определяющие положение электронов в атоме
- •7. Порядок заполнения атомных орбиталей.
- •Упражнения:
- •1.Периодический закон д. И. Менделеева
- •2. Свойства атомов химических элементов.
- •2.3. Характеристика кислородных соединений элементов. Элементов.
- •2.3.1. Состав соединений.
- •2.3.2. Кислотно-основные свойства соединений.
- •2.3.3. Окислительно-восстановительные свойства соединений.
- •3.Периодическая система элементов д. И. Менделеева.
- •3.2.Группы таблицы Менделеева
- •3.3. Периодичность изменения свойств элементов.
- •Упражнения:
- •4.3. Составление структурных формул молекул.
- •4.4.Ионная связь и ее свойства
- •4.5. Водородная связь и ее свойства.
- •Определение типа и свойств связи в молекуле.
- •Составление структурных формул соединений Упражнения:
- •5.2.Донорно–акцепторный механизм ковалентной связи
- •5.3.Комплексные соединения.
- •Ответы.
- •Лекция 7. Термохимия
- •1. Предмет и основные понятия химической термодинамики.
- •7.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
- •Задачи.
- •8.3. Химический потенциал. Активность и коэффициент активности. Условия химического равновесия.
- •8.1. Химический потенциал. Активность и коэффициент активности.
- •8.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
- •Упражнения.
- •9.5. Фазовое равновесие. Правило фаз.
- •Фазовая диаграмма воды
- •9.6.Упражнения для самоконтроля направлены на закрепление умения пользоваться следующими закономерностями:
- •10.6.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Задания
- •7. Произведение растворимости
- •11.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Задания
- •12.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Лекция 13. Органические полимерные материалы. Органические полимерные материалы. Методы получения полимеров, полимеризация, поликонденсация. Строение и свойства полимеров. Применение полимеров.
- •Наиболее часто встречающиеся синтетические полимеры
- •14.3.Электродные потенциалы активных и пассивных металлов
- •Термодинамика гальванического элемента.
- •14.6.Потенциал редокси-электродов.
- •14.5.Упражнения для самоконтроля направлены на закрепление знаний в области расстановки коэффициентов в уравнениях овр, электродных потенциалов, гальванических элементов.
- •17.1 Классификация методов анализа.
8.3. Химический потенциал. Активность и коэффициент активности. Условия химического равновесия.
8.1. Химический потенциал. Активность и коэффициент активности.


8.2. Условия химического равновесия. Обратимые и необратимые реакции.


8.4.Константа равновесия и ее связь с термодинамическими функциями. Термодинамический вывод закона действия масс для хим. равновесия
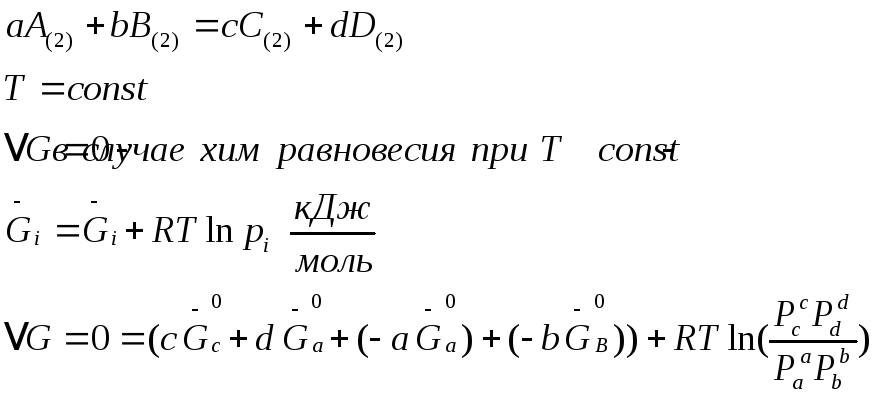
Давления равновесны

т.к.
![]()
![]()
при
данной Т – постоянна, можно написать
![]()
равновесные.
Она определяет предел хим. реакции при
данной Т- она постоянна
![]() -
законы химии позволяют перейти от одной
константы к другой.
-
законы химии позволяют перейти от одной
константы к другой.
![]()
![]()
![]() -применение
числа молей разнообразных веществ в
хим. реакции.
-применение
числа молей разнообразных веществ в
хим. реакции.
![]()
![]() -мольная
доля компонента а.
-мольная
доля компонента а.
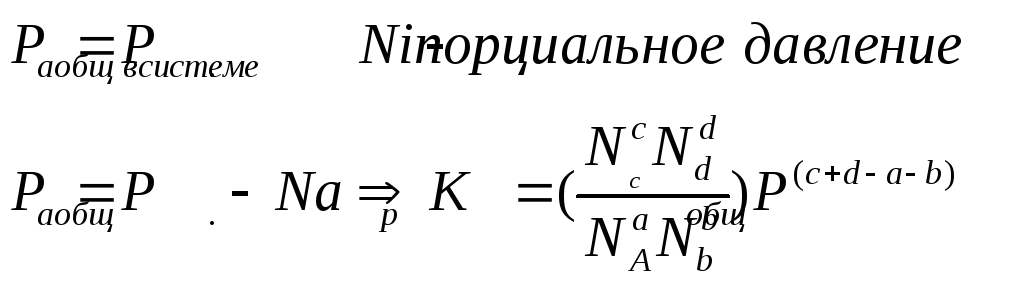
![]()
Константа химического равновесия зависит только от температуры.
8.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
-
Определение вероятности протекания реакций в открытой и изолированной системах.
-
Определение температурных условий наступления химического равновесия..
Упражнения.
1.Рассчитайте при температуре 25о
С стандартное изменение свободной
энергии Гиббса образования оксида Fе2О3
из соответствующих простых веществ,
если известны стандартная энтальпии
образования (![]() ,кДж/моль)
и стандартные энтропия образования(Δ
,кДж/моль)
и стандартные энтропия образования(Δ![]() ,Дж/моль·К)
данного оксида. Может ли данная реакция
протекать самопроизвольно?
,Дж/моль·К)
данного оксида. Может ли данная реакция
протекать самопроизвольно?
![]() = -824
= -824
![]() ,ДЖ/мольК=
78
,ДЖ/мольК=
78
2. По приведенным стандартным значениям изменения энтальпии и энтропии для химической реакции рассчитайте температуру, при которой равновероятны прямое и обратное направления данной реакции. В каком направлении, прямом или обратном, данная реакция будет протекать самопроизвольно при более высоких температурах?
|
Реакция
|
|
|
|
СО2(г)+С(г)=2СО(г) |
+ 173 |
+176;
|
Ответы:1-; 2-
Лекция 9. Химическая кинетика: Скорость реакции, химическое равновесие..
Понятие скорости реакции . Зависимость скорости реакции от концентрации реагентов. Зависимость скорости реакции от температуры. Химическое равновесие. Принцип Ле Шателье Фазовое равновесие. Правило фаз.
9.1. Понятие скорости реакци Раздел химии, изучающий скорости и механизмы протекания реакций, называется химической кинетикой. Под скоростью химической реакции понимается изменение количества вещества за какой-то промежуток времени:
![]() .
.
Различают скорость реакции в гомогенных (однородных) и гетерогенных (неоднородных) системах. В гомогенных системах реакции протекают по всему объему:
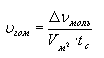 .
.
В гетерогенных системах реакции протекают на границе фаз, поэтому изменение количества вещества относят к площади раздела фаз:
![]() .
.
Скорость реакции зависит от следующих факторов: природа реагирующих веществ; концентрация реагирующих веществ; газовое давление; температура, катализатор.
9.2.Зависимость скорости
реакции от концентрации
реагирующих веществ подчиняется закону
действия масс: скорость химической
реакции прямо пропорциональна произведению
концентраций реагирующих веществ,
каждая из которых взята в степени, равной
соответствующему стехиометрическому
коэффициенту в уравнении реакции
(Гульдберг, Ваге).
Запишем
химическую реакцию в общем виде:![]() .
.
Если считать, что реакция протекает в гомогенной среде, то закон действия масс для неё выглядит следующим образом:
![]() ,
,
где [А] и [В] – молярные концентрации веществ А и В; а и в – показатели степеней, соответствующие количеству моль веществ А и В; к – константа скорости реакции, зависящая от температуры, но не зависящая от концентрации реагирующих веществ. Уравнение для скорости реакции называется кинетическим уравнением химической реакции. Рассмотрим закон действия масс для конкретных реакций:
 .
Цинк
– твердое вещество, его участие в реакции
учитывается константой скорости
химической реакции.
.
Цинк
– твердое вещество, его участие в реакции
учитывается константой скорости
химической реакции.
9.3. Зависимость скорости гомогенной реакции от температуры. Влияние температуры на скорость химической реакции подчиняется правилу Вант-Гоффа: При изменении температуры на 10oС, скорость реакции изменяется в 2÷4 раза.
![]() где
ν - начальная скорость реакции;
ν'-измененная
скорость;
γ- температурный коэффициент;
Δt0-
изменение температуры реакции. Зависимость
константы скорости реакции от температуры
также подчиняется уравнению Вант-Гоффа:
где
ν - начальная скорость реакции;
ν'-измененная
скорость;
γ- температурный коэффициент;
Δt0-
изменение температуры реакции. Зависимость
константы скорости реакции от температуры
также подчиняется уравнению Вант-Гоффа:![]()
Пример решения задачи
При 20oС
скорость реакции составляет 0,5. Чему
равна скорость той же реакции при 70oС,
если температурный коэффициент равен
2?
Решение: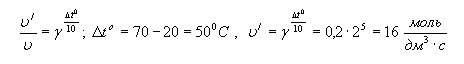 .
.
9.3. Химическое равновесие характерно для обратимых реакций.. Обратимыми называются реакции, в которых ни одно из исходных веществ до конца не расходуется. Обратимые реакции с определенного момента протекают в обоих направлениях – прямом и обратном:
 .
.
В обратимых реакциях
устанавливается состояние равновесия,
которое выражается в равенстве скоростей
прямой и обратной реакций:![]() Состояние
равновесия характеризуется константой
равновесия (Кр):
Состояние
равновесия характеризуется константой
равновесия (Кр):
 .
.
Индекс
"р" означает равновесные концентрации
веществ. Состояние равновесия устойчиво
и может сохраняться как угодно долго,
пока на систему не будет оказано
какое-либо внешнее воздействие: изменение
концентрации реагирующих веществ;
изменение газового давления; изменение
температуры. Нарушение состояния
равновесия обратимой реакции означает,
что скорости прямой и обратной реакций
не равны друг другу. В зависимости от
этого, равновесие обратимой реакции
смещается либо в прямом
![]() ,
либо в обратном
,
либо в обратном
![]() направлении.
Направление смещения обратимой реакции
подчиняется принципу
Ле Шателье: "Если на систему, находящуюся
в равновесии, оказать какое-либо внешнее
воздействие, то равновесие сместится
в таком направлении, чтобы ослабить
оказанное воздействие".
направлении.
Направление смещения обратимой реакции
подчиняется принципу
Ле Шателье: "Если на систему, находящуюся
в равновесии, оказать какое-либо внешнее
воздействие, то равновесие сместится
в таком направлении, чтобы ослабить
оказанное воздействие".
