
- •3. Фактор эквивалентности. Эквивалентные массы и эквивалентные объемы.
- •3.1Фактор эквивалентности химического элемента х в его соединениях равен:
- •3.2.Фактор эквивалентности вещества х, участвующего в окислительно-восстановительном процессе, равен:
- •3.3.Фактор эквивалентности вещества х, участвующего в ионообменном процессе, равен:
- •5.Применение закона эквивалентов.
- •1. Состав атома
- •Характеристики основных частиц, составляющих атом
- •3. Ядерные реакции
- •5. Атомные орбитали. Квантовые числа..
- •6. Законы, определяющие положение электронов в атоме
- •7. Порядок заполнения атомных орбиталей.
- •Упражнения:
- •1.Периодический закон д. И. Менделеева
- •2. Свойства атомов химических элементов.
- •2.3. Характеристика кислородных соединений элементов. Элементов.
- •2.3.1. Состав соединений.
- •2.3.2. Кислотно-основные свойства соединений.
- •2.3.3. Окислительно-восстановительные свойства соединений.
- •3.Периодическая система элементов д. И. Менделеева.
- •3.2.Группы таблицы Менделеева
- •3.3. Периодичность изменения свойств элементов.
- •Упражнения:
- •4.3. Составление структурных формул молекул.
- •4.4.Ионная связь и ее свойства
- •4.5. Водородная связь и ее свойства.
- •Определение типа и свойств связи в молекуле.
- •Составление структурных формул соединений Упражнения:
- •5.2.Донорно–акцепторный механизм ковалентной связи
- •5.3.Комплексные соединения.
- •Ответы.
- •Лекция 7. Термохимия
- •1. Предмет и основные понятия химической термодинамики.
- •7.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
- •Задачи.
- •8.3. Химический потенциал. Активность и коэффициент активности. Условия химического равновесия.
- •8.1. Химический потенциал. Активность и коэффициент активности.
- •8.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
- •Упражнения.
- •9.5. Фазовое равновесие. Правило фаз.
- •Фазовая диаграмма воды
- •9.6.Упражнения для самоконтроля направлены на закрепление умения пользоваться следующими закономерностями:
- •10.6.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Задания
- •7. Произведение растворимости
- •11.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Задания
- •12.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Лекция 13. Органические полимерные материалы. Органические полимерные материалы. Методы получения полимеров, полимеризация, поликонденсация. Строение и свойства полимеров. Применение полимеров.
- •Наиболее часто встречающиеся синтетические полимеры
- •14.3.Электродные потенциалы активных и пассивных металлов
- •Термодинамика гальванического элемента.
- •14.6.Потенциал редокси-электродов.
- •14.5.Упражнения для самоконтроля направлены на закрепление знаний в области расстановки коэффициентов в уравнениях овр, электродных потенциалов, гальванических элементов.
- •17.1 Классификация методов анализа.
Термодинамика гальванического элемента.
На Е влияют следующие факторы: температура, природа реагирующих веществ, концентрация реагирующих веществ.1. Природа реагирующих веществ:
1)
![]()
![]() n – валентность, Ф – число
Фарадея
n – валентность, Ф – число
Фарадея
2)
![]()
![]() Работе
противостоит сила внешнего давления.
Работе
противостоит сила внешнего давления.
2.Влияние температуры на Э.Д.С.
![]()
![]()
![]()
![]()
![]() - изменение энтропии. Если
- изменение энтропии. Если
![]() то
то
![]() Если
Если
![]() то
то
![]()
3. Зависимость Е от концентрации
Пусть в гальваническом элементе протекает реакция следующего типа:
![]() где С – концентрация
где С – концентрация
![]() левую и правую части делим на
левую и правую части делим на
![]()
![]()
Если
температура постоянная, то
![]()
![]() - стандартная Э.Д.С., соответствующая
тому простому случаю, когда
- стандартная Э.Д.С., соответствующая
тому простому случаю, когда
![]()
Для
стандартных условий: Т=298 К, р=1атм
![]() - уравнение Нериста для гальванического
элемента. Ф = 96500
- уравнение Нериста для гальванического
элемента. Ф = 96500
![]()
14.5. Водородный электрод сравнения и измерение ЭДС.. Водородный электрод сравнения удобен тем, что стандартный электродный потенциал водорода равен нулю. φ02H+|H2= 0,00В.Водородный электрод представляет собой сосуд, в котором находится H2SO4 с концентрацией [H+] = 1 моль/л. Электрод выполняется из платины, которая сверху покрыта слоем рыхлой платины. Платина, особенно рыхлая, является прекрасным адсорбентом газообразного водорода. Извне в этот сосуд подается газообразный водород под давлением в 1атм. Платиновый электрод поглощает водород и практически становится водородным электродом. Электроды сравнения необходимы по той причине, что не существует методов непосредственного измерения электродных потенциалов. Возможно только измерение ЭДС гальванического элемента и вычисление неизвестного потенциала по известному. Для определения потенциалов электродов по водородной щкале собирают гальванический элемент, одним из электродов которого является измеряемый, а вторым –стандартный водородный электрод с электродом из того металла, потенциал которого необходимо измерить.
Измерение ЭДС данного гальванического
элемента производится компенсационным
методом. Схема включает в себя реохорд,
рис.3.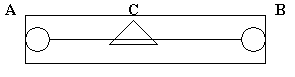
Реохорд - длинная деревянная линейка, по краям которой находятся металлические зажимы, между зажимами туго натянута стальная струна определенного сопротивления. По струне перемещается металлический движок. В схему включены аккумулятор и гальванометр. Движок реохорда перемещают до тех пор, пока стрелка гальванометра не остановится на нуле. Это - состояние компенсации, для которого справедливо соотношение:
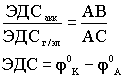 ,где
ЭДСакк- ЭДС аккумулятора, ЭДСг/эл
- ЭДС гальванического элемента, AB - длина
линейки, AC - расстояние до движка
(состояние компенсации).
,где
ЭДСакк- ЭДС аккумулятора, ЭДСг/эл
- ЭДС гальванического элемента, AB - длина
линейки, AC - расстояние до движка
(состояние компенсации).
14.6.Потенциал редокси-электродов.
Концентрационные гальванические элементы Особенностью концентрационного гальванического элемента является то, что оба электрода выполнены из одного и того же метала. Эти электроды отличаются друг от друга только концентрациями солевых растворов.
 .
По
формуле Нерста рассчитаем
ЭДС концентрационного элемента.
.
По
формуле Нерста рассчитаем
ЭДС концентрационного элемента. ![]()
![]() Недостатки
концентрационных гальванических
элементов: разрушаемый анод, малая ЭДС.
Концентрационные элементы используются
в тех случаях, где необходима малая ЭДС.
Окислительно - восстановительные
(ОВ) гальванические элементы: Особенностью
данных элементов является то, что
окислительно - восстановительный процесс
протекает только в растворах. Оба
электрода являются инертными, или
пассивными, т.е. сами они не принимают
участия в ОВ процессах, а выполняют роль
проводников электронов.
Недостатки
концентрационных гальванических
элементов: разрушаемый анод, малая ЭДС.
Концентрационные элементы используются
в тех случаях, где необходима малая ЭДС.
Окислительно - восстановительные
(ОВ) гальванические элементы: Особенностью
данных элементов является то, что
окислительно - восстановительный процесс
протекает только в растворах. Оба
электрода являются инертными, или
пассивными, т.е. сами они не принимают
участия в ОВ процессах, а выполняют роль
проводников электронов.
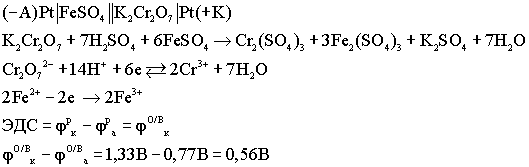
Топливные элементы(ТЭ) Электрохимические
реакции очень медленные. Для ускорения
процессов советский инженер Давтян
предложил ввести в окислительно –
восстановительные гальванические
элементы катализаторы. Суть топливных
элементов заключается в том,
что электроды являются одновременно и
катализаторами. Топливо, т.е. восстановитель
и окислитель, хранится вне гальванических
элементов и подаётся на электроды по
мере необходимости, рис.2.Э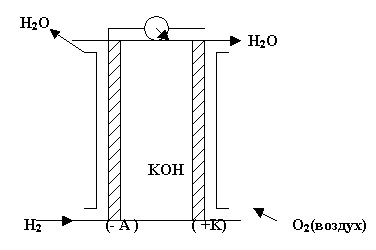 лектроды
выполняются из пористого Ni или пористой
Pt, то есть тех металлов, которые являются
катализаторами электродных процессов.
В качестве электролита используется
раствор гидроксида калия.
Схема
кислородно- водородного ТЭ может быть
записана в виде:
лектроды
выполняются из пористого Ni или пористой
Pt, то есть тех металлов, которые являются
катализаторами электродных процессов.
В качестве электролита используется
раствор гидроксида калия.
Схема
кислородно- водородного ТЭ может быть
записана в виде:![]() .
.
На аноде элемента протекает реакция окисления водорода:
![]() .На
катоде восстанавливается кислород:
.На
катоде восстанавливается кислород:
![]() .Суммированием
анодной и катодной реакций получаем
уравнение токообразующей реакции:
.Суммированием
анодной и катодной реакций получаем
уравнение токообразующей реакции:![]() ,в
результате которой химическая энергия
непосредственно превращается в
электрическую.Пример применения
топливных элементов - использование их
в мобильниках
фирмы Toshiba.
,в
результате которой химическая энергия
непосредственно превращается в
электрическую.Пример применения
топливных элементов - использование их
в мобильниках
фирмы Toshiba.
