
- •3. Фактор эквивалентности. Эквивалентные массы и эквивалентные объемы.
- •3.1Фактор эквивалентности химического элемента х в его соединениях равен:
- •3.2.Фактор эквивалентности вещества х, участвующего в окислительно-восстановительном процессе, равен:
- •3.3.Фактор эквивалентности вещества х, участвующего в ионообменном процессе, равен:
- •5.Применение закона эквивалентов.
- •1. Состав атома
- •Характеристики основных частиц, составляющих атом
- •3. Ядерные реакции
- •5. Атомные орбитали. Квантовые числа..
- •6. Законы, определяющие положение электронов в атоме
- •7. Порядок заполнения атомных орбиталей.
- •Упражнения:
- •1.Периодический закон д. И. Менделеева
- •2. Свойства атомов химических элементов.
- •2.3. Характеристика кислородных соединений элементов. Элементов.
- •2.3.1. Состав соединений.
- •2.3.2. Кислотно-основные свойства соединений.
- •2.3.3. Окислительно-восстановительные свойства соединений.
- •3.Периодическая система элементов д. И. Менделеева.
- •3.2.Группы таблицы Менделеева
- •3.3. Периодичность изменения свойств элементов.
- •Упражнения:
- •4.3. Составление структурных формул молекул.
- •4.4.Ионная связь и ее свойства
- •4.5. Водородная связь и ее свойства.
- •Определение типа и свойств связи в молекуле.
- •Составление структурных формул соединений Упражнения:
- •5.2.Донорно–акцепторный механизм ковалентной связи
- •5.3.Комплексные соединения.
- •Ответы.
- •Лекция 7. Термохимия
- •1. Предмет и основные понятия химической термодинамики.
- •7.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
- •Задачи.
- •8.3. Химический потенциал. Активность и коэффициент активности. Условия химического равновесия.
- •8.1. Химический потенциал. Активность и коэффициент активности.
- •8.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
- •Упражнения.
- •9.5. Фазовое равновесие. Правило фаз.
- •Фазовая диаграмма воды
- •9.6.Упражнения для самоконтроля направлены на закрепление умения пользоваться следующими закономерностями:
- •10.6.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Задания
- •7. Произведение растворимости
- •11.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Задания
- •12.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Лекция 13. Органические полимерные материалы. Органические полимерные материалы. Методы получения полимеров, полимеризация, поликонденсация. Строение и свойства полимеров. Применение полимеров.
- •Наиболее часто встречающиеся синтетические полимеры
- •14.3.Электродные потенциалы активных и пассивных металлов
- •Термодинамика гальванического элемента.
- •14.6.Потенциал редокси-электродов.
- •14.5.Упражнения для самоконтроля направлены на закрепление знаний в области расстановки коэффициентов в уравнениях овр, электродных потенциалов, гальванических элементов.
- •17.1 Классификация методов анализа.
2.3. Характеристика кислородных соединений элементов. Элементов.
2.3.1. Состав соединений.
|
Валентности |
||||||
|
Ι |
ΙI |
III |
IV |
V |
VI |
VIΙ |
|
Оксиды |
||||||
|
Э2О |
ЭО |
Э2О3 |
ЭО2 |
Э2О5 |
ЭО3 |
Э2О7 |
|
Гидроксиды |
||||||
|
МеОН |
Ме(ОН)2 |
Ме(ОН)3 |
Ме(ОН)4 |
НЭО3 |
Н2 ЭО4 |
НЭО4 |
|
|
Н2 МеО2 |
Н3МеО3(орто-форма) |
Н4МеО4(орто-форма) |
|
|
|
|
|
|
НМеО2(мета-форма) |
Н2МеО3 (мета-форма) |
|
|
|
2.3.2. Кислотно-основные свойства соединений.
В зависимости от валентности, проявляемой элементом в соединении, оно может проявлять разные свойства.
|
основные |
амфотерные |
кислотные |
|
характерны для |
||
|
соединений металлов с валентностью 1-2(кроме исключений) |
соединений Pb, Sn, Be, Zn с валентностью 2 |
соединений металлов с валентностью 5-7 |
|
|
соединений металлов с валентностью 3-4 |
соединений неметаллов с валентностью 1-7 |
|
С увеличением валентности возрастают кислотные свойства соединений. |
||
2.3.3. Окислительно-восстановительные свойства соединений.
Если элемент в соединении находится в высшей степени окисления, то данное соединение может быть только окислителем,;Если элемент в соединении находится в низшей степени окисления, то данное соединение может быть только восстановителем,;Если элемент в соединении находится в промежуточной степени окисления, то данное соединение проявляет двойственные свойства, то есть может быть как окислителем, так и восстановителем; С увеличением степени окисления возрастают окислительные свойства соединений.
3.Периодическая система элементов д. И. Менделеева.
3.1. Периоды. Таблица состоит из 7 периодов. Первые три периода малые, последние четыре периода большие. Физический смысл номера периода заключается в том, что номер периода соответствует главному квантовому числу или количеству электронных уровней у всех элементов данного периода.. Ёмкость первого энергетического уровня равна двум электронам (N=2), следовательно, первый период состоит из двух элементов:
|
|
S-элементами называют элементы, у которых заполняются электронами S-подуровни. |
Ёмкость второго энергетического уровня N = 8. Длина второго периода составляет 8 элементов.
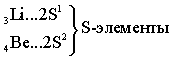
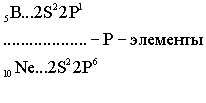 В
силу первого закона Клечковского длина
и строение третьего периода в точности
повторяют второй: два S - элемента, шесть
P - элементов. Каждый период начинается
с двух S – элементов, которые, за
исключением водорода и гелия, являются
самыми активными металлами. Каждый
период заканчивается активными
неметаллами, за исключением благородных
газов - химически инертых веществ.
В
силу первого закона Клечковского длина
и строение третьего периода в точности
повторяют второй: два S - элемента, шесть
P - элементов. Каждый период начинается
с двух S – элементов, которые, за
исключением водорода и гелия, являются
самыми активными металлами. Каждый
период заканчивается активными
неметаллами, за исключением благородных
газов - химически инертых веществ.
Формирование больших периодов Четвёртый период – первый большой период (18 элементов)
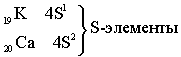
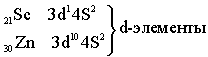
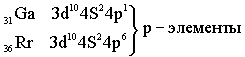
Пятый период. Длина и строение пятого периода в точности повторяет длину и строение четвёртого периода.
Шестой период. Лантан принимает первый электрон на подуровень 5d, затем, в соответствии со вторым законом Клечковского, заполнение электронами подуровня 5d приостанавливается, и начинает заполнятся электронами подуровень 4f.
|
58Сe |
4S1 5S2 5p6 5d1 6S2 |
|
|
71Lu |
4f14 5S2 5p6 5d1 6S2 |
|
|
72Hf |
5d2 6S2 |
После заполния электронами подуровня 4f продолжается заполние подуровня 5d, снова появляются d-элементы. |
|
80Hg |
5d10 6S2 |
Заканчивается период шестью p-элементами. Таким образом, 6-й период имеет следующее строение:S – элементы – 2, d – элементы – 1, f – элементы – 14,d – элементы – 9, p – элементы – 6 / Всего 32 элемента. Седьмой период в точности повторяет длину и строение шестого периода. Все трансурановые элементы, начиная с 93Np, являются искусственными.В больших периодах характер изменения свойств элементов тот же, что и в малых, только замедленный. Все S – элементы, кроме Н и Не, - самые активные металлы. Все d и f – элементы тоже металлы. р – элементы частично металлы, частично неметаллы.

