
- •3. Фактор эквивалентности. Эквивалентные массы и эквивалентные объемы.
- •3.1Фактор эквивалентности химического элемента х в его соединениях равен:
- •3.2.Фактор эквивалентности вещества х, участвующего в окислительно-восстановительном процессе, равен:
- •3.3.Фактор эквивалентности вещества х, участвующего в ионообменном процессе, равен:
- •5.Применение закона эквивалентов.
- •1. Состав атома
- •Характеристики основных частиц, составляющих атом
- •3. Ядерные реакции
- •5. Атомные орбитали. Квантовые числа..
- •6. Законы, определяющие положение электронов в атоме
- •7. Порядок заполнения атомных орбиталей.
- •Упражнения:
- •1.Периодический закон д. И. Менделеева
- •2. Свойства атомов химических элементов.
- •2.3. Характеристика кислородных соединений элементов. Элементов.
- •2.3.1. Состав соединений.
- •2.3.2. Кислотно-основные свойства соединений.
- •2.3.3. Окислительно-восстановительные свойства соединений.
- •3.Периодическая система элементов д. И. Менделеева.
- •3.2.Группы таблицы Менделеева
- •3.3. Периодичность изменения свойств элементов.
- •Упражнения:
- •4.3. Составление структурных формул молекул.
- •4.4.Ионная связь и ее свойства
- •4.5. Водородная связь и ее свойства.
- •Определение типа и свойств связи в молекуле.
- •Составление структурных формул соединений Упражнения:
- •5.2.Донорно–акцепторный механизм ковалентной связи
- •5.3.Комплексные соединения.
- •Ответы.
- •Лекция 7. Термохимия
- •1. Предмет и основные понятия химической термодинамики.
- •7.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
- •Задачи.
- •8.3. Химический потенциал. Активность и коэффициент активности. Условия химического равновесия.
- •8.1. Химический потенциал. Активность и коэффициент активности.
- •8.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
- •Упражнения.
- •9.5. Фазовое равновесие. Правило фаз.
- •Фазовая диаграмма воды
- •9.6.Упражнения для самоконтроля направлены на закрепление умения пользоваться следующими закономерностями:
- •10.6.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Задания
- •7. Произведение растворимости
- •11.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Задания
- •12.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Лекция 13. Органические полимерные материалы. Органические полимерные материалы. Методы получения полимеров, полимеризация, поликонденсация. Строение и свойства полимеров. Применение полимеров.
- •Наиболее часто встречающиеся синтетические полимеры
- •14.3.Электродные потенциалы активных и пассивных металлов
- •Термодинамика гальванического элемента.
- •14.6.Потенциал редокси-электродов.
- •14.5.Упражнения для самоконтроля направлены на закрепление знаний в области расстановки коэффициентов в уравнениях овр, электродных потенциалов, гальванических элементов.
- •17.1 Классификация методов анализа.
9.5. Фазовое равновесие. Правило фаз.
Равновесие перехода из одной фазы в другую без изменения химического состава называется фазовым равновесием. Примеры: переходы твердое вещество-жидкость-пар. Фазовое равновесие является динамическим равновесием,т.е. скорость прямого процесса равна скорости обратного процесса. Условием равновесия является ΔG=0.Для фазового равновесия соблюдается закон Ле-Шателье. К наиболее общим законам фазового равновесия относится правило фаз Гиббса.: Число степеней свободы С, фаз Ф, независимых компонентов К и внешних условий П, влияющих на равновесие, взаимосвязаны соотношением: С=К-Ф+П Под компонентами системы принято понимать химические вещества, которые могут существовать в изолированном виде и определять состав системы. Независимые компоненты – те, наименьшее число которых достаточно для образования всех фаз системы. Число степеней свободы – вариабельность системы; число независимых друг от друга факторов равновесия (число факторов, которые можно менять произвольно, не нарушая состояния системы) На фазовое равновесие обычно влияют температура и давление, П = 2, т.е. С=К-Ф+2. Для однокомпонентных систем правило фаз имеет вид: С=3-Ф=2, т.е . однофазная система имеет две степени свободы, двухфазная система имеет одну степень свободы, трехфазная система не имеет степеней свободы.
Фазовая диаграмма воды
Области между кривыми являются однофазными(С=2). Кривые соответствуют условиям равновесия между двумя фазами(С=1). В точке О существует равновесие между тремя фазами(С=0)- т.н тройная точка воды
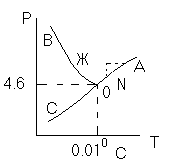 0А
– равновесие (жидкость - пар)
0А
– равновесие (жидкость - пар)
0В – Жидкость - лед
0С – пар-лед (испарение)
9.6.Упражнения для самоконтроля направлены на закрепление умения пользоваться следующими закономерностями:
-
Закон действующих масс
-
правило Вант-Гоффа..
-
Закон Ле-Шателье
Задачи
-
Как изменится скорость прямой гомогенной реакции 2А+2В=С+2D, если давление в системе увеличить в два раза?
-
Температурный коэффициент скорости некоторой реакции равен 2. Во сколько раз увеличится скорость этой реакции, если температуру повысить на 20 0С?
-
Составить выражение для константы равновесия реакции 2HBr(г)=H2(г)+Br2(г). Как необходимо изменить внешние факторы (температуру, давление, концентрацию исходного вещества), чтобы сместить равновесие реакции в сторону образования продуктов реакции? Тепловой эффект прямой реакции рассчитать в соответствии с законом Гесса.
Ответы
Лекция 10. Растворы. Свойства растворов
Понятие о растворах. Способы выражения количественного состава растворов. Закон эквивалентов для реакций в растворах. Основные законы растворов: законы Рауля и Вант – Гоффа. Особенности применения этих законов для растворов электролитов. Теория С. Аррениуса.
10.1. Понятие о растворах. Способы выражения количественного состава растворов Раствором называется твердая или жидкая гомогенная (однородная) система, состоящая из двух или более компонентов. Необходимыми компонентами раствора являются растворитель и растворенное вещество, например, растворенный в воде сахар. В одном растворителе может находиться несколько растворенных веществ. Например, в воде растворены сахар, соль и уксусная кислота. Количество растворенного вещества в определенном количестве раствора или растворителя, которое может колебаться в очень широких пределах, называется концентрацией раствора. Существует несколько способов выражения концентрации растворов.
![]() Х
– концентрация
Х
– концентрация
![]() Y – концентрация
Y – концентрация
![]()
g
– процентная концентрация
![]()
![]() -
плотность
-
плотность
![]()
1мл.=1см3
С, СМ,
М – молярность
![]()
Сэ,
Н – нормальность
![]()
Сm
,m – моляльность
![]()
Т –
титр
![]()
N
– мольная доля
![]()
Виды растворов:
-
Разбавленные (малой концентрации)
-
Концентрированные (большой концентрации)
-
Насыщенные (предельно допустимая концентрация)
Пересыщенные (концентрация больше предельно допустимой, такие растворы неравновесные)
Пример 1. Какую массу воды нужно прибавить к 200мл 15% раствора Н2SO4 (=1,11 г/мл), чтобы получить 10%-ный раствор? Какова нормальность исходного раствора?
Решение. масса 200мл 15%-ного раствора Н2SO4 равна 2001,11=222г. В этом растворе содержится 15% Н2SO4 т.е. 2220,15=33,3г.
-
По условию задачи эта масса составит 10% от общей массы
разбавленного раствора. Тогда масса полученного раствора будет равна
![]() .
.
-
Следовательно, к исходному раствору необходимо добавить воды
mH2O = mр2-ра - m1 р-ра = 333-222=111г.
-
По определению, нормальность раствора равна количеству эквивалентов Н2SО4 в 1л раствора:
![]() ,
,
![]() .
.
Таким образом, нормальность исходного раствора равна 3,4 экв/л.
Ответ: m(Н2О)=111 г; СН=3,4 н.
Закон эквивалентов для растворов.
Если два раствора взаимодействуют между
собой в эквивалентных количествах, то
зная концентрацию одного из растворов
и прореагировавшие объемы обоих
растворов, можно рассчитать неизвестную
концентрацию второго раствора по
соотношению:
![]() .
.
2. Основные законы растворов: законы Рауля и Вант – Гоффа. Эти законы являются коллигативными, то – есть зависят не только от концентрации растворов, но и от количества частиц в них.
I закон Рауля Относительное понижение давления паров растворителя над раствором ( р) равно мольной доле растворенного вещества.
p= p0-p1=
p0
![]() ,
(6.1)
,
(6.1)
где р1 – парциальное давление насыщенного пара растворителя над раствором; р0 – давление насыщенного пара над чистым растворителем;
1 – количество растворителя; 2 – количество растворенного вещества.
закон Рауля При растворении вещества расширяется температурный интервал существования жидкой фазы растворителя вследствие смещения его температуры кристаллизации (замерзания) в низкотемпературную область, а температуры кипения – в высокотемпературную):
Тф.п. = К Сm , (6.2)
где Тф.п. –изменение температуры фазового перехода (кристаллизации или кипения), К – коэффициент пропорциональности, зависящий от свойств растворителя; для кристаллизации – криоскопическая константа (Кк), для кипения – эбуллиоскопическая константа (Кэ). Для наболее распространенного растворителя-воды эти константы равны: Кк = 1,86К/моль, Кэ = 0,52К/моль.
Ст– моляльная концентрация растворенного вещества.
3. Закон Вант-Гоффа:
|
Закон Вант – Гоффа определяет величину осмотического давления раствора. Чтобы ознакомиться с понятием осмоса, рассмотрим сосуд, разделённый на две части полупроницаемой мембраной. Полупроницаемая мембрана – перегородка, через которую проникают молекулы растворителя, но не проходят частицы растворённого вещества. Осмос представляет собой самопроизвольное одностороннее перемещение молекул растворителя через полупроницаемую мембрану из той части системы, где концентрация растворителя выше, в ту часть системы, где его концентрация ниже.
|
При постоянной температуре осмотическое давление раствора Р пропорционально его молярной концентрации
Р=1000СМ RT, Па
где СМ – молярная концентрация, R- газовая постоянная (8,314 Дж/мольК),Т – температура, К
Пример 2. При какой температуре замерзает водный раствор, полученный из 250г воды и 54 г глюкозы С6Н12О6 ?
Решение. При пересчете на 1000г воды, содержание глюкозы в растворе равно 216 г. Так как мольная масса глюкозы составляет 180 г/моль, то моляльность раствора равна Сm=216/180=1,20 моль/кг (Н2О) .
По формуле (6.2) находим:
tкрист =К Сm =1,861,20=2,23С.
Т.к. чистая вода кристаллизуется при 0С, то раствор будет кристаллизоваться при tкр р-ра= t кр.р-ля- t крист=00С-2,23=-2,230С
Ответ: tкрист = - 2,23С.
3.Особенности применения законов Рауля и Вант-Гоффа для растворов электролитов. Теория С. Аррениуса. Электролиты – вещества, которые в воде диссоциируют на ионы. Существует три класса электролитов: кислоты, гидроксиды, соли. Растворы электролитов имеют две особенности по сравнению с растворами неэлектролитов: проводят электроток, подчиняются законам Рауля и Вант - Гоффа с определёнными отклонениями. Обе особенности растворов электролитов объяснила гипотеза шведского учёного Сванте Аррениуса (1883 г). Гипотеза Аррениуса сводилась к тому, что вещества неидеальных растворов, то - есть то, что сейчас называется растворами электролитов, в воде диссоциируют на ионы. Поскольку неидеальные растворы проводили электроток, то их называли растворами электролитов. Для растворов электролитов в математические выражения законов Рауля и Вант - Гоффа был введён поправочный коэффициент. Ввёл его Вант – Гофф и назвал его изотоническим коэффициентом. i - поправочный коэффициент (изотонический коэффициент).
|
Раствор неэлектролита |
|
Раствор электролита |
|
CB = 1 моль / л |
|
CB = 1 моль / л |
|
С12H22O11 |
|
NaСl= Na++Cl- |
|
Сахар в воде диссоциирует |
|
Соль в воде диссоциирует |
|
на молекулы |
|
на ионы |
|
1 моль молекул |
|
1 моль Na+ 1 моль Cl- |
|
|
|
Частиц будет больше |
|
|
|
в 2 раза |
|
|
|
Al(NO3)3=Al3++3NO-3 |
|
|
|
Al(NO3) = Al3+ + 3NO-3 |
|
|
|
(в 4 раза больше) |
|
|
|
1) 1< i <2 |
|
|
|
2) 1< i <4 |
Законы Рауля для растворов электролитов:
ΔP / РА = i NB,
Тф.п. = i К Сm Закон Вант – Гоффа для растворов электролитов: Росмотическое = i RTCB
Физический смысл изотонического коэффициента состоит в том, что он учитывает увеличение количества частиц в растворе электролита по сравнению с раствором неэлектролита той же концентрации.
пример найти изотонический коэффициент для раствора электролита с концентрацией растворенного вещества 0,2М, если известно, что в 1 дм3 этого раствора содержится 2,18·1023 частиц (молекул и ионов) растворенного вещества.
Решение: i=Nфакт/Nрасч., где Nфакт- количество частиц(молекул и ионов) растворенного вещества, присутствующих в растворе; Nрасч - количество молекул растворенного вещества. i=Nфакт/ NА· СМ = 2,18·1023/(6,02·1023·0,2) = ,

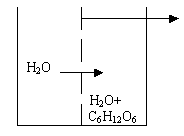 Определение
осмотического давления растворов
производится следующим образом. Во
внешний сосуд наливается чистая вода,
стенки внутреннего сосуда представляют
собой полупроницаемую мембрану.
Внутренний сосуд снабжен оттянутой
горловиной и мерительной линейкой.
Во внутреннем сосуде находится какой
- либо раствор, например, сахара. В силу
осмоса молекулы воды из внешнего
сосуда через полупроницаемые стенки
будут проходить во внутренний, движение
молекул в этом приборе только
одностороннее. Таким образом, объём
раствора во внутреннем сосуде
увеличивается и поднимается по
оттянутой горловине. В результате
разницы в уровнях жидкостей во внешнем
и внутреннем сосудах в приборе возникает
гидростатическое давление. Это давление
препятствует осмосу. Величина
гидростатического давления, при
которой осмос прекращается, называется
осмотическим давлением раствора.
(Росмотическое,
кПа )
Определение
осмотического давления растворов
производится следующим образом. Во
внешний сосуд наливается чистая вода,
стенки внутреннего сосуда представляют
собой полупроницаемую мембрану.
Внутренний сосуд снабжен оттянутой
горловиной и мерительной линейкой.
Во внутреннем сосуде находится какой
- либо раствор, например, сахара. В силу
осмоса молекулы воды из внешнего
сосуда через полупроницаемые стенки
будут проходить во внутренний, движение
молекул в этом приборе только
одностороннее. Таким образом, объём
раствора во внутреннем сосуде
увеличивается и поднимается по
оттянутой горловине. В результате
разницы в уровнях жидкостей во внешнем
и внутреннем сосудах в приборе возникает
гидростатическое давление. Это давление
препятствует осмосу. Величина
гидростатического давления, при
которой осмос прекращается, называется
осмотическим давлением раствора.
(Росмотическое,
кПа )