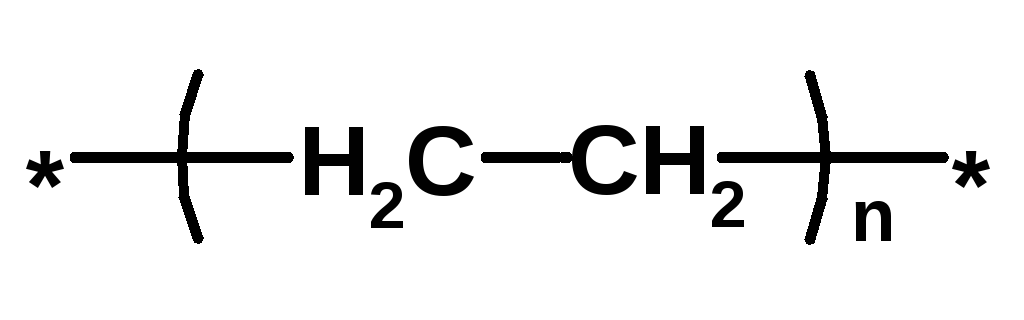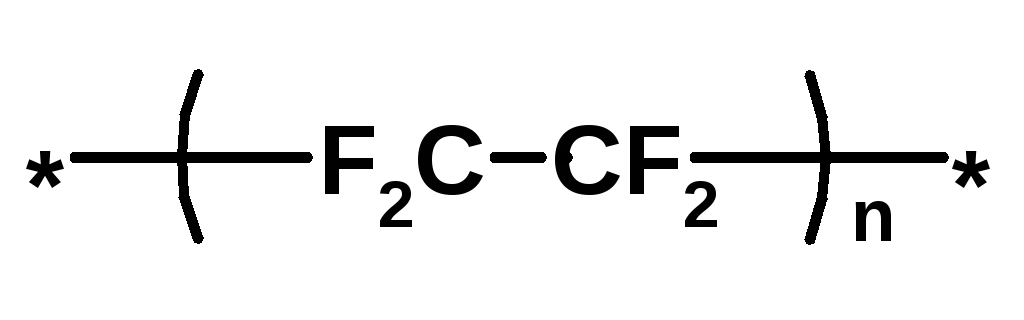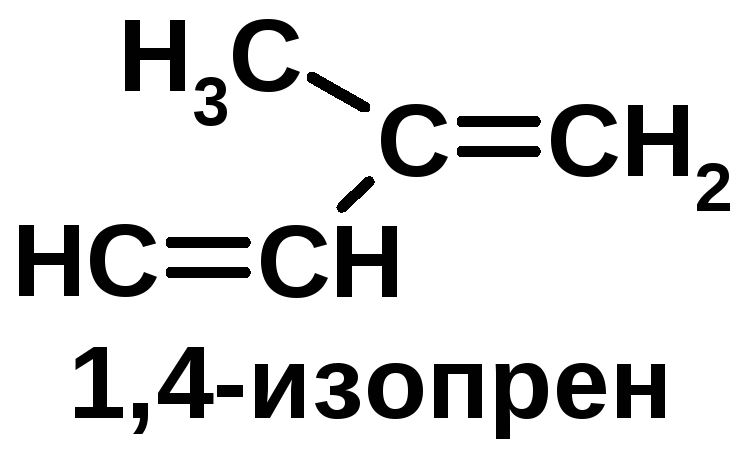- •3. Фактор эквивалентности. Эквивалентные массы и эквивалентные объемы.
- •3.1Фактор эквивалентности химического элемента х в его соединениях равен:
- •3.2.Фактор эквивалентности вещества х, участвующего в окислительно-восстановительном процессе, равен:
- •3.3.Фактор эквивалентности вещества х, участвующего в ионообменном процессе, равен:
- •5.Применение закона эквивалентов.
- •1. Состав атома
- •Характеристики основных частиц, составляющих атом
- •3. Ядерные реакции
- •5. Атомные орбитали. Квантовые числа..
- •6. Законы, определяющие положение электронов в атоме
- •7. Порядок заполнения атомных орбиталей.
- •Упражнения:
- •1.Периодический закон д. И. Менделеева
- •2. Свойства атомов химических элементов.
- •2.3. Характеристика кислородных соединений элементов. Элементов.
- •2.3.1. Состав соединений.
- •2.3.2. Кислотно-основные свойства соединений.
- •2.3.3. Окислительно-восстановительные свойства соединений.
- •3.Периодическая система элементов д. И. Менделеева.
- •3.2.Группы таблицы Менделеева
- •3.3. Периодичность изменения свойств элементов.
- •Упражнения:
- •4.3. Составление структурных формул молекул.
- •4.4.Ионная связь и ее свойства
- •4.5. Водородная связь и ее свойства.
- •Определение типа и свойств связи в молекуле.
- •Составление структурных формул соединений Упражнения:
- •5.2.Донорно–акцепторный механизм ковалентной связи
- •5.3.Комплексные соединения.
- •Ответы.
- •Лекция 7. Термохимия
- •1. Предмет и основные понятия химической термодинамики.
- •7.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
- •Задачи.
- •8.3. Химический потенциал. Активность и коэффициент активности. Условия химического равновесия.
- •8.1. Химический потенциал. Активность и коэффициент активности.
- •8.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
- •Упражнения.
- •9.5. Фазовое равновесие. Правило фаз.
- •Фазовая диаграмма воды
- •9.6.Упражнения для самоконтроля направлены на закрепление умения пользоваться следующими закономерностями:
- •10.6.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Задания
- •7. Произведение растворимости
- •11.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Задания
- •12.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Лекция 13. Органические полимерные материалы. Органические полимерные материалы. Методы получения полимеров, полимеризация, поликонденсация. Строение и свойства полимеров. Применение полимеров.
- •Наиболее часто встречающиеся синтетические полимеры
- •14.3.Электродные потенциалы активных и пассивных металлов
- •Термодинамика гальванического элемента.
- •14.6.Потенциал редокси-электродов.
- •14.5.Упражнения для самоконтроля направлены на закрепление знаний в области расстановки коэффициентов в уравнениях овр, электродных потенциалов, гальванических элементов.
- •17.1 Классификация методов анализа.
12.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
-
Классификация коллоидных систем
-
устойчивость коллоидных систем.
-
поверхностные явления
Упражнения:
1.Дисперсной системой является: а)соляной раствор, б) молоко; в) сахар; г) минеральная вода
2.Согласно теории строения коллоидных растворов мицелла является : а)электронейтральной, б) отрицательно заряженной, ; в) положительно заряженной; г) радикалом
3. Для золя AgI, полученного по реакции AgNO3(изб) + KI = AgI↓ + КNO3 коагуляцию вызывают : а)катионы, б) анионы; в) катионы +анионы; г) нейтральные частицы
4.При растворении в воде ПАВ величина поверхностного натяжения: а)уменьшается, б) не изменяется, ; в) увеличивается; г) уменьшается, затем увеличивается.
Лекция 13. Органические полимерные материалы. Органические полимерные материалы. Методы получения полимеров, полимеризация, поликонденсация. Строение и свойства полимеров. Применение полимеров.
13.1. Органические полимерные материалы. Полимер – макромолекула, построенная из одинаковых повторяющихся фрагментов (мономерных единиц). Мономер – исходное для полимера низкомолекулярное вещество – определяет строение всего полимера.
Различают неорганические, органические и элементоорганические полимеры. Органические, в свою очередь, делятся на природные и синтетические. В качестве природных полимеров можно назвать белки и углеводы (крахмал и целлюлоза)

Углеводы построены из остатков α-глюкозы.
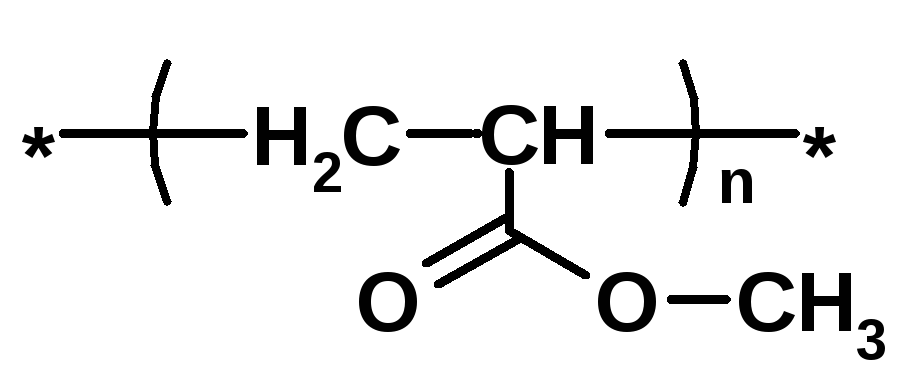
Полимерная цепь может состоять из повторяющихся фрагментов одного типа или нескольких разных типов. В последнем случае говорят о сополимере.
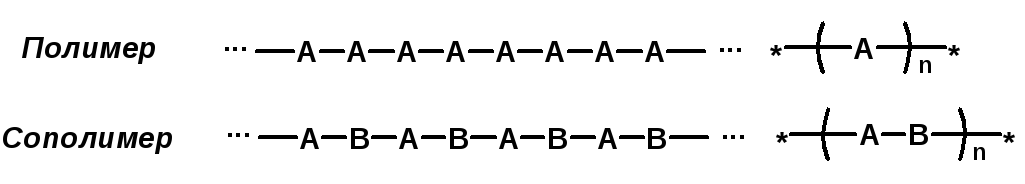
Типы полимеров:
-
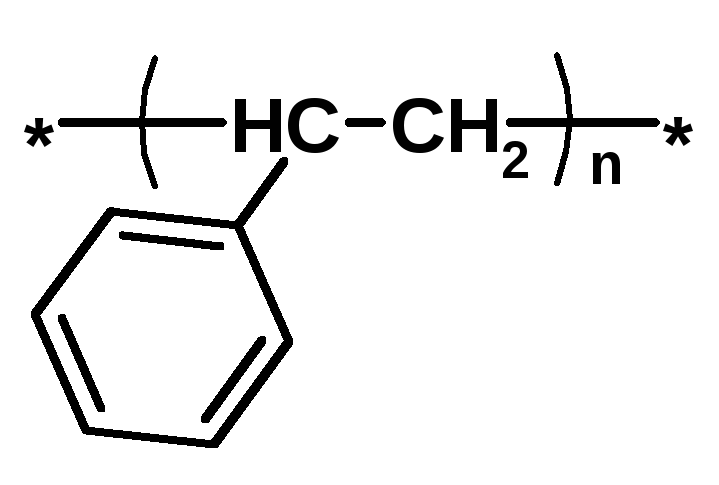
Термопласт – полимер, способный легко менять форму при нагревании (полиэтилен, полипропилен, полиэтилентерефталат, полистирол ….)
-
Эластопласт – способен растягиваться в несколько раз и обратимо восстаннавливать форму после снятия деформирующего усилия (каучуки, резины)
-
Реактопласт – полимер, в котором при обработке протекают необратимые реакции дополимеризации, что делает невозможность их дальнейшей термической деформации (обработки)
Наиболее часто встречающиеся синтетические полимеры
|
Полимер |
Мономер |
Формула |
|
Полиэтилен Высокого давления Низкого давления |
|
|
|
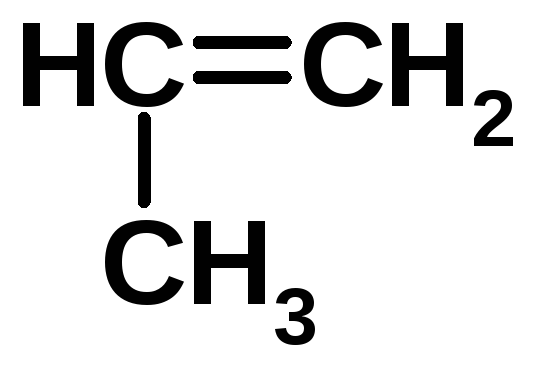
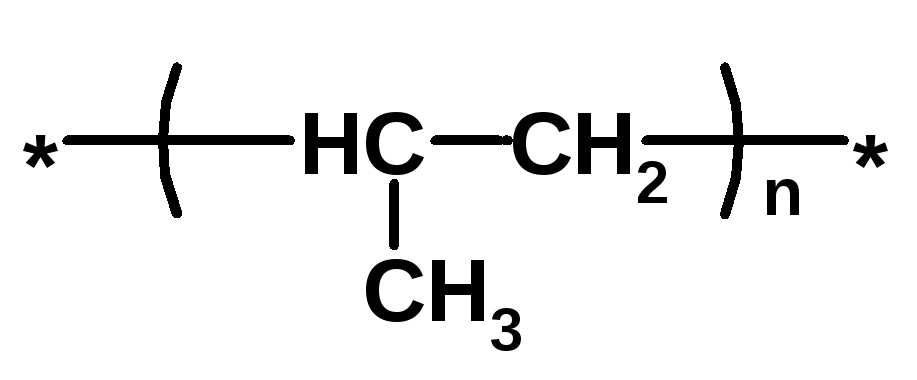
Полипропилен PP |
|
|
|
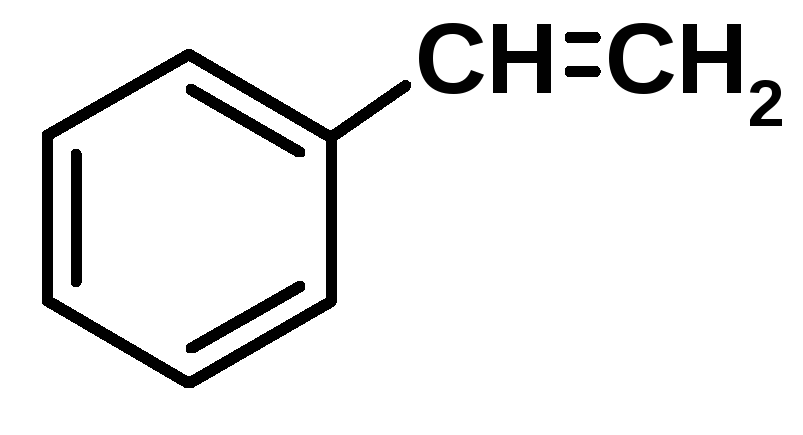
Полистирол PS |
|
|
|
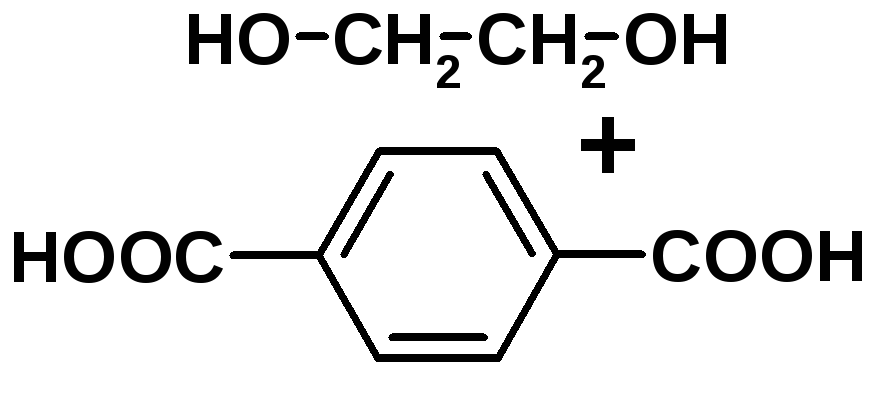
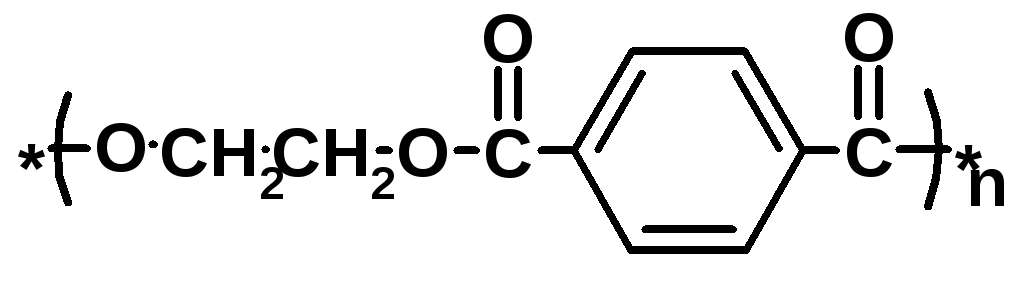
Полиэтилентерефталат PET Лавсан Полиэфир, полиэстер |
|
|
|
Политетерафторэтилен, Тефлон |
|
|
|
Полиметилметакрилат
оргстекло |
|
|
|
Натуральный каучук |
|
|
13.2.Методы получения полимеров,




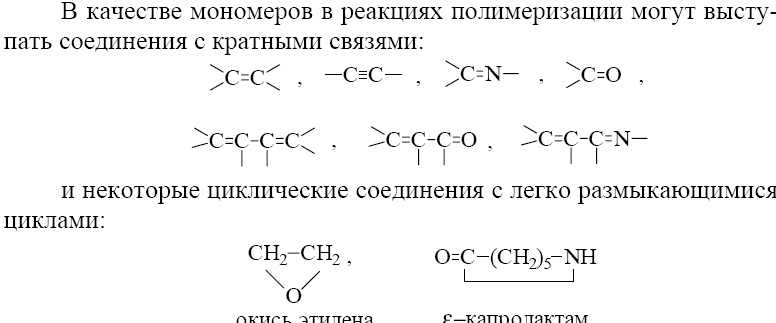
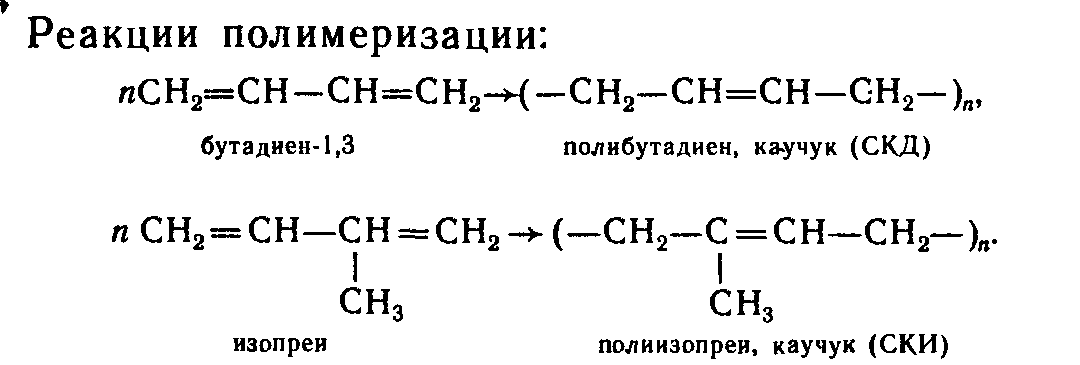
![]()


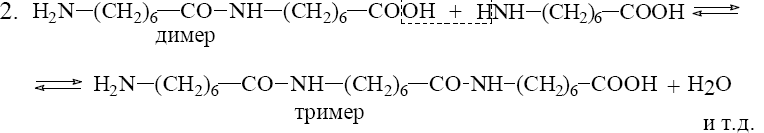
![]()
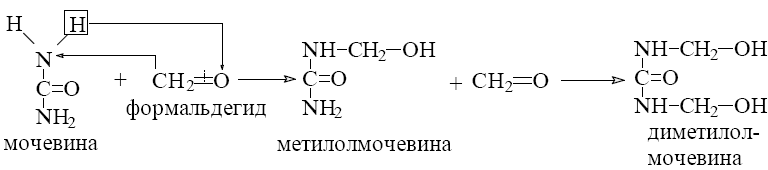
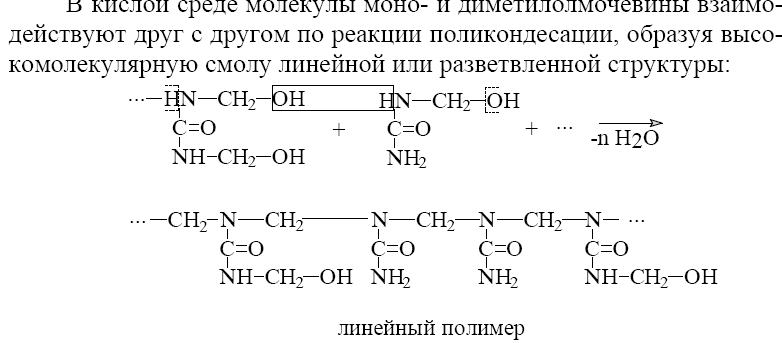
13.3. Строение полимеров.
13.1.3.1. Форма и структура макромолекул полимеров.




13.3.2. Физические состояния полимеров..





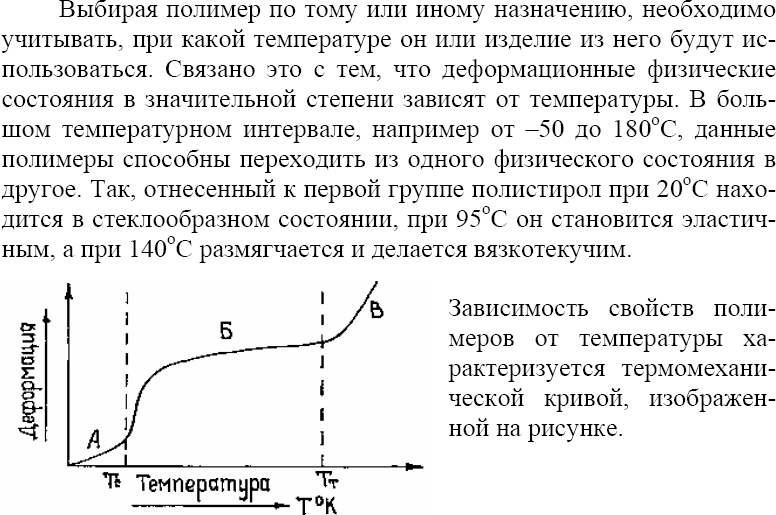


13.3.3. Физико –механические свойства полимеров.


![]()

![]()


Химические свойства полимеров.


![]()
![]()
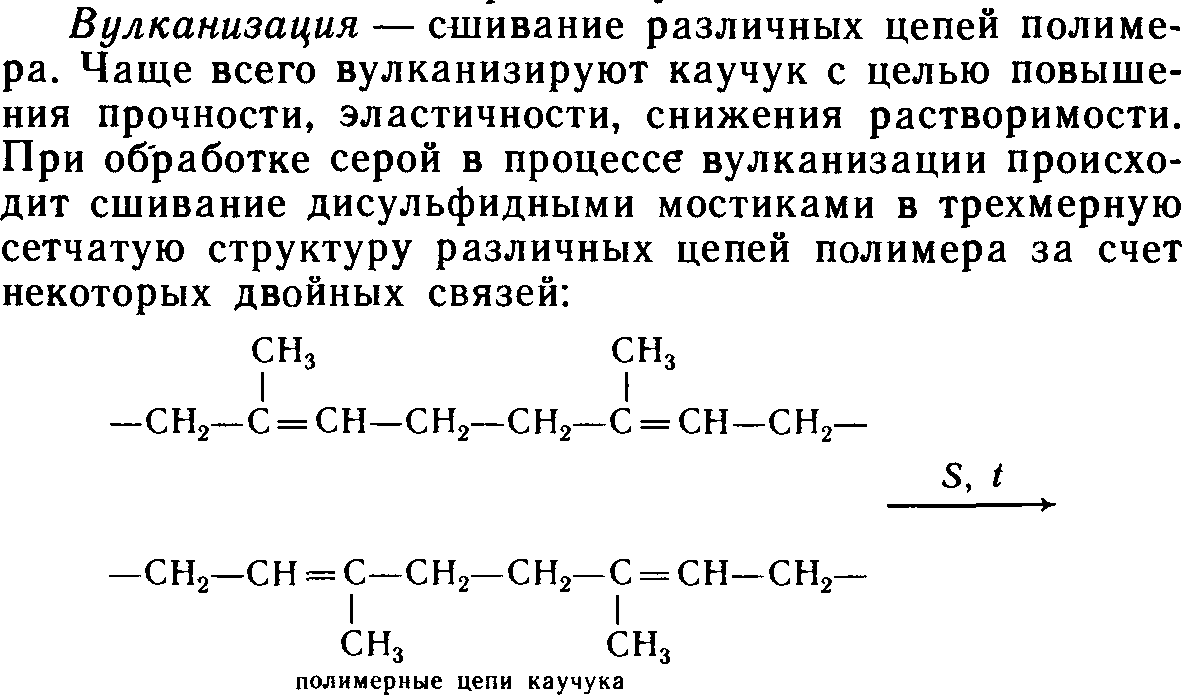
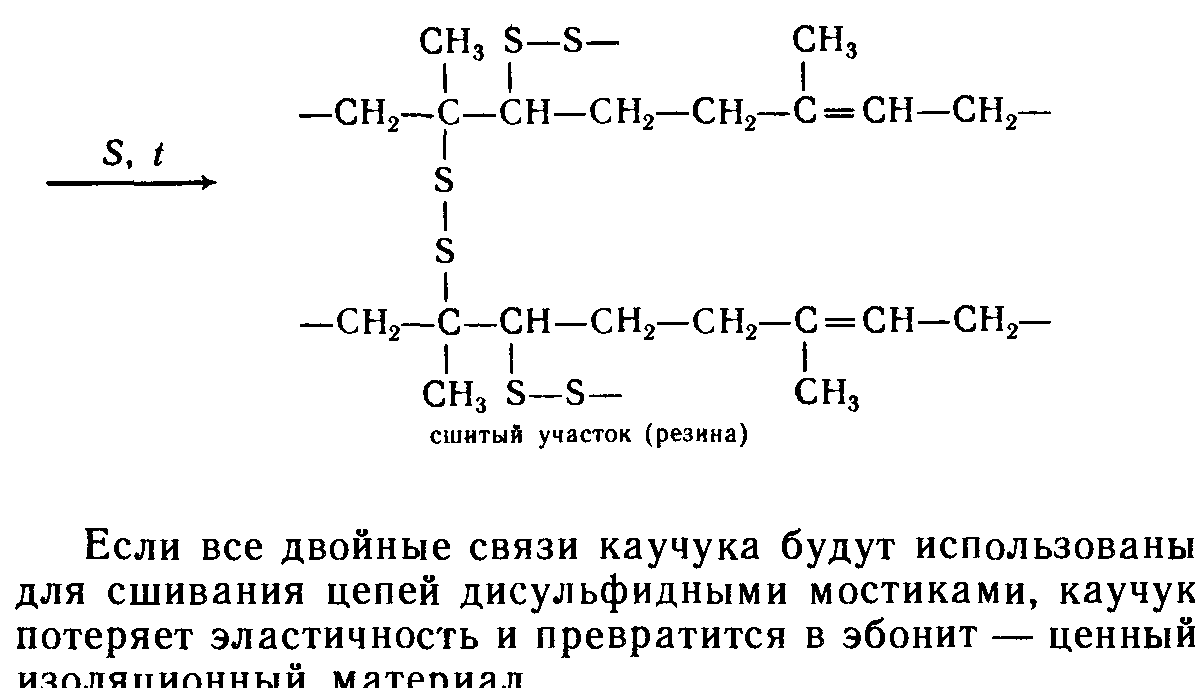


13.5.Упражнения для самоконтроля направлены на закрепление знаний в области: классификации, состава и свойств полимеров.
Задания.
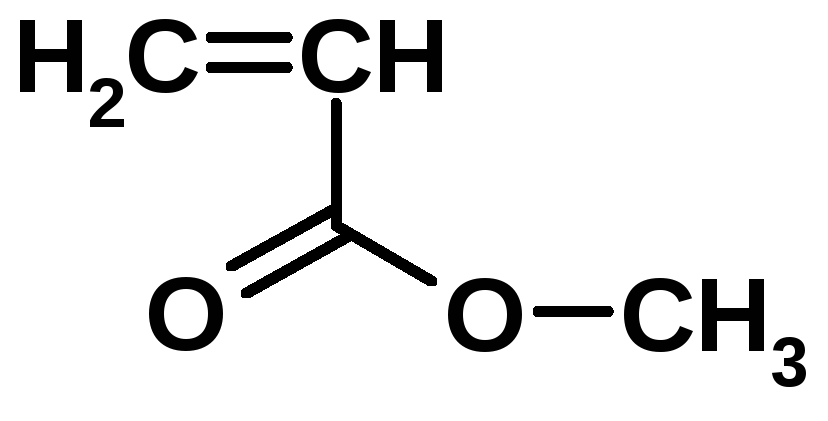
1. полиэтилен получают в результате реакции: а) вулканизации, б) сополимеризации; в)поликонденсации, г)полимеризации.
2. макромолекулы природного каучука имеют : а) сетчатую структуру, б) разветвленную структуру; в) линейную структуру, г) беспорядочную структуру.
3. Полимер состава: (-СН2-С = СН – СН2-)n называют:
|
СН3 а) полипропилен б) резина в)каучук г) пластмасса
O O // | |
4.Определите тип реакции: n NH2-(CH2)5-C → (-NH-(CH2)5-C-)n + nH2O \ OH а) полимеризация б) поликонденсация в) изомеризация г) гидратация
Лекция 14. Окислительно-восстановительные процессы
Окислительно-восстановительные реакции. Понятие об электродных потенциалах. Гальванические элементы, ЭДС и ее измерение. Стандартный водородный электрод и водородная шкала потенциалов. Уравнение Нернста. Потенциалы металлических, газовых и окислительно-восстановительных электродов. Концентрационные и топливные гальванические элементы.
-
14.1. Окислительно-восстановительные реакции Окислительно-восстановительными называются реакции, которые сопровождаются изменением степени окисления атомов, входящих в состав реагирующих веществ. Атом элемента в высшей степени окисления является только окислителем (например, сера в молекуле H2SO4 имеет высшую степень окисления 6+); атом элемента в низшей степени окисления является только восстановителем (например, сера в молекуле H2S имеет низшую степень окисления 2-); атом элемента находящийся в промежуточной степени окисления может быть и окислителем и восстановителем (например, сера в молекуле H2SO3 имеет промежуточную степень окисления 4-). Такие соединения проявляют окислительно-восстановительную двойственность и способны к реакциям диспропорционирования.
Пример 1. Завершить уравнение реакции, дописав недостающие продукты. Составить уравнения полуреакций окисления и восстановления, на их основе написать уравнения реакций в ионной и молекулярной формах:
KNO2+KI+H2SO4J2+NO + …`
Решение. В реакции иод меняет степень окисления от -1 в иодиде калия до нуля в I2. Иод теряет электроны, т.е. окисляется. Восстанавливаться в данной реакции будет азот, который меняет степень окисления от +3 до +2. Нитрит–ион восстанавливается до NO с приобретением одного электрона на каждый атом азота. Избыточный кислород нитрит-иона будет связываться водородными ионами кислой среды с образованием воды:
-

NO-2+2H++e=NO+H2O
2I—2e=I2

2NO-2+4H++2I-=2NO+2H2O+I2
2
1
Полученное уравнение является уравнением искомой реакции в ионной форме. Молекулярное уравнение реакции получится , если учесть, что ионы калия, освобождающиеся при разрушении молекул KNO2 и KJ образуют соли с серной кислотой: 2KNO2+2KI+2H2SO4J2+2NO +2 К2SO4+2 H2O.
 14.2.
Понятие об электродных потенциалах.
Общие свойства металлов: электропроводность,
теплопроводность, пластичность,-
обусловлены типом химической связи в
металлах, которая так и называется
металлическая
связь.
Суть металлической связи заключается
в том, что часть атомов в металле теряет
свои валентные электроны, превращаясь
в ионы.
14.2.
Понятие об электродных потенциалах.
Общие свойства металлов: электропроводность,
теплопроводность, пластичность,-
обусловлены типом химической связи в
металлах, которая так и называется
металлическая
связь.
Суть металлической связи заключается
в том, что часть атомов в металле теряет
свои валентные электроны, превращаясь
в ионы.
![]() Таким
образом, в узлах кристаллической решетки
любого металла располагаются как
нейтральные атомы, так и положительные
ионы. Потерянные электроны располагаются
в междоузлиях, образуя так называемый
коллективный
электронный газ.Ионы
металла, располагающиеся на его границе,
гидратируются молекулами воды:.
Таким
образом, в узлах кристаллической решетки
любого металла располагаются как
нейтральные атомы, так и положительные
ионы. Потерянные электроны располагаются
в междоузлиях, образуя так называемый
коллективный
электронный газ.Ионы
металла, располагающиеся на его границе,
гидратируются молекулами воды:.![]() ,Под
влиянием всевозможных видов движения
гидратированные ионы отрываются от
металла и уходят в воду:
,Под
влиянием всевозможных видов движения
гидратированные ионы отрываются от
металла и уходят в воду:
![]() .На
границе металла и воды возникает двойной
электрический слой, т.е. скачок потенциала
Up,В,
который называется равновесным
электродным потенциалом.
Знак потенциала определяется по заряду
металла. Количество ионов металла,
содержащихся в литре насыщенного
раствора, называется растворимостью
металла.
По величине растворимости металлы
подразделяются на:активные и пассивныe.
.На
границе металла и воды возникает двойной
электрический слой, т.е. скачок потенциала
Up,В,
который называется равновесным
электродным потенциалом.
Знак потенциала определяется по заряду
металла. Количество ионов металла,
содержащихся в литре насыщенного
раствора, называется растворимостью
металла.
По величине растворимости металлы
подразделяются на:активные и пассивныe.