- •3. Фактор эквивалентности. Эквивалентные массы и эквивалентные объемы.
- •3.1Фактор эквивалентности химического элемента х в его соединениях равен:
- •3.2.Фактор эквивалентности вещества х, участвующего в окислительно-восстановительном процессе, равен:
- •3.3.Фактор эквивалентности вещества х, участвующего в ионообменном процессе, равен:
- •5.Применение закона эквивалентов.
- •1. Состав атома
- •Характеристики основных частиц, составляющих атом
- •3. Ядерные реакции
- •5. Атомные орбитали. Квантовые числа..
- •6. Законы, определяющие положение электронов в атоме
- •7. Порядок заполнения атомных орбиталей.
- •Упражнения:
- •1.Периодический закон д. И. Менделеева
- •2. Свойства атомов химических элементов.
- •2.3. Характеристика кислородных соединений элементов. Элементов.
- •2.3.1. Состав соединений.
- •2.3.2. Кислотно-основные свойства соединений.
- •2.3.3. Окислительно-восстановительные свойства соединений.
- •3.Периодическая система элементов д. И. Менделеева.
- •3.2.Группы таблицы Менделеева
- •3.3. Периодичность изменения свойств элементов.
- •Упражнения:
- •4.3. Составление структурных формул молекул.
- •4.4.Ионная связь и ее свойства
- •4.5. Водородная связь и ее свойства.
- •Определение типа и свойств связи в молекуле.
- •Составление структурных формул соединений Упражнения:
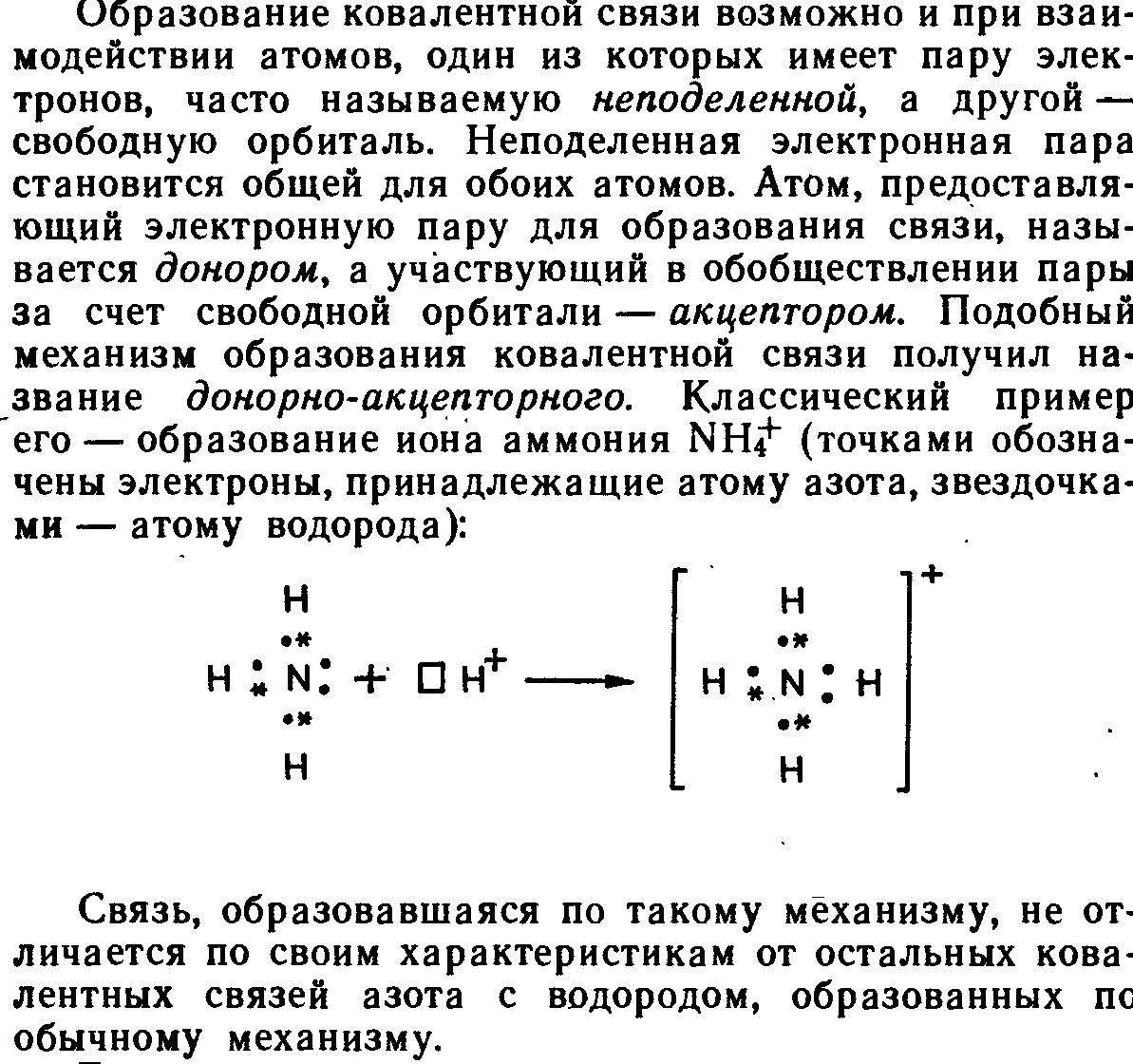
- •5.2.Донорно–акцепторный механизм ковалентной связи
- •5.3.Комплексные соединения.
- •Ответы.
- •Лекция 7. Термохимия
- •1. Предмет и основные понятия химической термодинамики.
- •7.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
- •Задачи.
- •8.3. Химический потенциал. Активность и коэффициент активности. Условия химического равновесия.
- •8.1. Химический потенциал. Активность и коэффициент активности.
- •8.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
- •Упражнения.
- •9.5. Фазовое равновесие. Правило фаз.
- •Фазовая диаграмма воды
- •9.6.Упражнения для самоконтроля направлены на закрепление умения пользоваться следующими закономерностями:
- •10.6.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Задания
- •7. Произведение растворимости
- •11.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Задания
- •12.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Лекция 13. Органические полимерные материалы. Органические полимерные материалы. Методы получения полимеров, полимеризация, поликонденсация. Строение и свойства полимеров. Применение полимеров.
- •Наиболее часто встречающиеся синтетические полимеры
- •14.3.Электродные потенциалы активных и пассивных металлов
- •Термодинамика гальванического элемента.
- •14.6.Потенциал редокси-электродов.
- •14.5.Упражнения для самоконтроля направлены на закрепление знаний в области расстановки коэффициентов в уравнениях овр, электродных потенциалов, гальванических элементов.
- •17.1 Классификация методов анализа.
-
Определение типа и свойств связи в молекуле.
-
Составление структурных формул соединений Упражнения:
-
Укажите вещества с преимущественно ионным типом связи:
а) Na2O б)H2O в) HCl г)H2
-
В каком из соединений образуется наименее прочная химическая связь ?
а ) NaF б ) NaCI в ) NaBr г ) NaI
-
Определите, графическая формула какой соли приведена ниже, напишите ее химическую формулу:
|
|
|
|
|
|
|
|
Ответы:
1. а) Na2O; 2. г ) NaI; 3. Fe2 (SO4)3
Лекция 5. Типы взаимодействия молекул
Основные виды межмолекулярного взаимодействия. Донорно-акцепторная связь. Комплексные соединения. Комплексы, комплексообразователи, лиганды, заряд и координационное число комплексов.
5.1. Основные виды межмолекулярного взаимодействия. Между молекулами может осуществляться как электростатическое, так и донорно-акцепторное взаимодействие.



5.2.Донорно–акцепторный механизм ковалентной связи
|
|
|
|
|
|
|
|
|
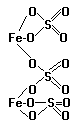
5.3.Комплексные соединения.



Во внешнюю сферу входят катионы или анионы. Комплексные соединения неэлектролиты не имеют внешней сферы, например, [Pt(NH3)2Cl4]. Типичными комплексообразователями являются d-элементы: Ag+,Au+,Cu+, Cu2+, Hg2+,Cd2+,Zn2+,Fe2+ , Fe3+, Co2+,Ni2+, Pt4+ и другие, а также s,p – элементы ( Ве, Al, Sn, Pb). Важнейшими лигандами являются:
-
нейтральные молекулы, имеющие дипольный момент: Н2О, NН3, СО, NО и другие;
-
ионы СN-, NО2-, Сl-, Br-,J-, S2O32-, ОН-, СО32- и другие.
Значения координационного числа (КЧ) для некоторых ионов комплексообразователей приведены в таблице :
|
КЧ=2 |
КЧ=4 |
КЧ=6 |
КЧ=8 |
|
Ag+,Au+,Cu+ |
Cu2+, Hg2+,Cd2+, Ве2+ ,Al3+, Pt2+ |
Zn2+,Fe2+,Fe3+, Co2+,Ni2+,Pt4+,Сr 3+ |
Cа2+, Ва2+, Sr2+, Ti4+ |
Как видно. чаще всего координационное число имеет значения 4 и 6. Заряд комплексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов. При этом заряд комплексообразователя принимается равным его степени окисления. Вследствие того, что любое комплексное соединение в целом электронейтрально, алгебраическая сумма зарядов внешней и внутренней сфер комплексного соединения равна нулю.
Пример 1. Вычислить заряды следующих комплексных ионов, образованных хромом (III): а)[CrCl(H2O)5]; б) [CrCl2(H2O)4]; в) [Cr(C2О4)2(H2O)2].
Решение. Заряд иона хрома (III) принимаем равным +3, заряд молекулы воды равен нулю, заряды хлорид- и оксалат-ионов соответственно равны -1 и -2. Составляем алгебраические суммы зарядов для каждого из указанных соединений:а)+3 + (-1) =+2; б)+3 +2(-1) = +1; в)+3 +2(-2) = -1.
Названия комплексных солей образуют по общему правилу: сначала называют анион, а затем – катион в родительном падеже. Название комплексного катиона составляют следующим образом: сначала указывают числа (используя греческие числительные: ди, три, тетра, пента, гекса и т.д.) и названия нейтральных лигандов, причем вода называется аква, а аммиак – аммин; Затем указывают числа и названия отрицательно заряженных лигандов с окончанием «о»( Cl- - хлоро, SO42- -сульфато, ОН—гидроксо и т.д.); последним называют комплексообразователь, указывая его степень окисления (в скобках римскими цифрами после названия комплексообразователя).
Пример 2. Назвать комплексные соли: [СоBr(NH3)5]SO4, Ва[Сr(SСN)4(NH3)2].
Решение: [PtCl(NH3)3]Cl –; [СоBr(NH3)5]SO4 – сульфат пентамминбромокобальта (III); Ва[Сr(SСN)4(NH3)2] –диамминтетрароданохромат (III) бария.


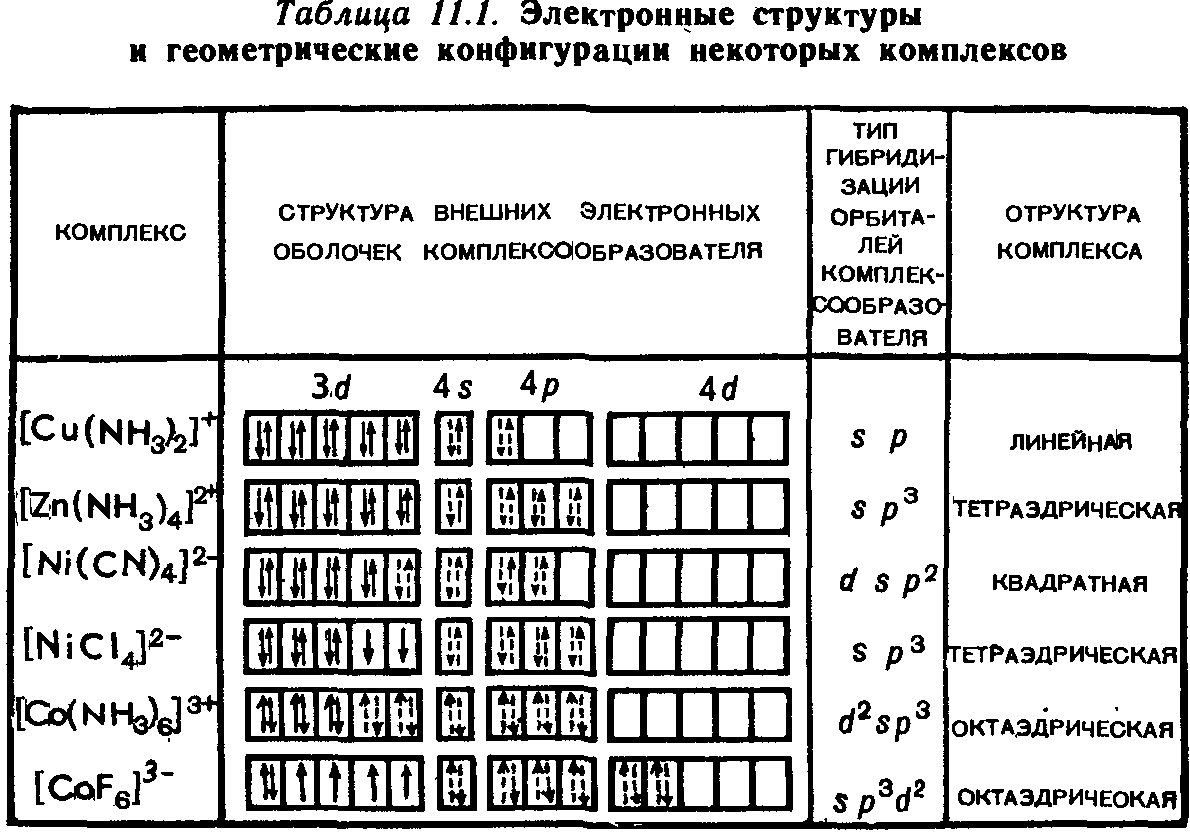
5.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
-
Определение строения комплексного соединения.
-
Составление названий комплексных соединений
-
Составить координационную формулу комплексной соли с названием хлорид триамминхлороплатины (II);
-
Вычислить заряд комплексного иона всоединении из п.1, иона-комплексообразователя, найти координационное число, указать лиганды