
- •3. Фактор эквивалентности. Эквивалентные массы и эквивалентные объемы.
- •3.1Фактор эквивалентности химического элемента х в его соединениях равен:
- •3.2.Фактор эквивалентности вещества х, участвующего в окислительно-восстановительном процессе, равен:
- •3.3.Фактор эквивалентности вещества х, участвующего в ионообменном процессе, равен:
- •5.Применение закона эквивалентов.
- •1. Состав атома
- •Характеристики основных частиц, составляющих атом
- •3. Ядерные реакции
- •5. Атомные орбитали. Квантовые числа..
- •6. Законы, определяющие положение электронов в атоме
- •7. Порядок заполнения атомных орбиталей.
- •Упражнения:
- •1.Периодический закон д. И. Менделеева
- •2. Свойства атомов химических элементов.
- •2.3. Характеристика кислородных соединений элементов. Элементов.
- •2.3.1. Состав соединений.
- •2.3.2. Кислотно-основные свойства соединений.
- •2.3.3. Окислительно-восстановительные свойства соединений.
- •3.Периодическая система элементов д. И. Менделеева.
- •3.2.Группы таблицы Менделеева
- •3.3. Периодичность изменения свойств элементов.
- •Упражнения:
- •4.3. Составление структурных формул молекул.
- •4.4.Ионная связь и ее свойства
- •4.5. Водородная связь и ее свойства.
- •Определение типа и свойств связи в молекуле.
- •Составление структурных формул соединений Упражнения:
- •5.2.Донорно–акцепторный механизм ковалентной связи
- •5.3.Комплексные соединения.
- •Ответы.
- •Лекция 7. Термохимия
- •1. Предмет и основные понятия химической термодинамики.
- •7.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
- •Задачи.
- •8.3. Химический потенциал. Активность и коэффициент активности. Условия химического равновесия.
- •8.1. Химический потенциал. Активность и коэффициент активности.
- •8.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
- •Упражнения.
- •9.5. Фазовое равновесие. Правило фаз.
- •Фазовая диаграмма воды
- •9.6.Упражнения для самоконтроля направлены на закрепление умения пользоваться следующими закономерностями:
- •10.6.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Задания
- •7. Произведение растворимости
- •11.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Задания
- •12.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Лекция 13. Органические полимерные материалы. Органические полимерные материалы. Методы получения полимеров, полимеризация, поликонденсация. Строение и свойства полимеров. Применение полимеров.
- •Наиболее часто встречающиеся синтетические полимеры
- •14.3.Электродные потенциалы активных и пассивных металлов
- •Термодинамика гальванического элемента.
- •14.6.Потенциал редокси-электродов.
- •14.5.Упражнения для самоконтроля направлены на закрепление знаний в области расстановки коэффициентов в уравнениях овр, электродных потенциалов, гальванических элементов.
- •17.1 Классификация методов анализа.
11.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
-
Ионные реакции в растворах..
-
Водородный показатель.
-
Гидролиз солей
-
Произведение растворимости.
-
Диссоциация комплексных соединений.
Задания
1, В какой смеси веществ возможна химическая реакция?
а ) Bi(OH)3 + NaOH ↔ б ) Bi(OH)3 + HCI
в ) Bi2S3 + H2O↔ г ) Bi2S3 + HCI ↔
разб.
2. pH=12, [H+]=?
а) 10-7 моль/л б ) 10-12 моль/л в ) 10-2 моль/л г) 10-6 моль/л
3. Какие вещества нужно добавить к раствору AI2(SO4)3 для смещения равновесия реакции гидролиза вправо?
a ) Na2SO4 ,б ) NaCI в ) HNO3 г ) Н2О
4. ПРAgCI=1,21·10-10. Рассчитать молярную растворимость:
а) 1,21·10-10моль/л б) 1,1·10-5моль/л в ) 2·10-5 моль/л
г) 1,2·10-3 моль/л
5. Какой заряд имеет ион [Fe2+(NC)5OH2] ?
а) 3- б ) -2 в ) 3+ г ) +2
Ответы:
Лекция 12. Дисперсные системы и поверхностные явления.
Дисперсность и дисперсные системы. Поверхностные явления. Коллоидные системы. Классификация коллоидных систем. Получение коллоидных растворов. Золи и гели. Мицеллы и их строение. Устойчивость коллоидных систем. Оптические и электрические свойства.
12.1 Дисперсность и дисперсные системы. Слово дисперсия означает раздробление, измельчение. Дисперсные системы состоят как минимум из двух компонентов: дисперсионной среды, которая играет роль растворителя и, следовательно, является непрерывной фазой; дисперсной фазы, играющей роль растворённого вещества.
Существуют два типа классификаций дисперсных систем.
Первый тип классификации основан на агрегатном состоянии дисперсионной среды и дисперсной фазы, табл.1. Таблица 1
|
Дисперсионная среда |
Дисперсная фаза |
Тип системы |
Примеры |
|
Жидкая |
Твёрдая |
Золи,суспензии |
Известковые, цементные растворы |
|
Жидкая |
Эмульсия |
Молоко, масло, сметана, керосин в воде |
|
|
Газообразная |
Пены |
Мыльная пена, морской прибой |
|
|
Твёрдая |
Твёрдая |
Твёрдые коллоиды |
Металлические сплавы |
|
Жидкая |
Пористые тела, насыщенные влагой |
Влажный грунт, опал, жемчуг |
|
|
Газообразная |
Твёрдые пены |
Газобетон, полистирол, пемза |
|
|
Газообразная |
Твёрдая |
Пыль , дым |
Угольная пыль |
|
Жидкая |
Туман |
Облака и тучи |
|
|
Газообразная |
Смесь газов |
Атмосфера земли |
Второй тип классификации основан на размерах частиц дисперсной фазы,табл.2.
Таблица 2
|
Размер частиц дисперсной фазы |
10-5 - 10-7 м |
10-7 - 10-4м |
<10-9м |
|
Название системы |
Грубо - дисперсная |
Коллоидно – дисперсная |
Молекулярно - дисперсная |
|
Характеристика системы |
Микрогетерогенная (по той причине, что границу раздела фаз можно увидеть только с помощью микроскопа) |
Гомогенная |
|
1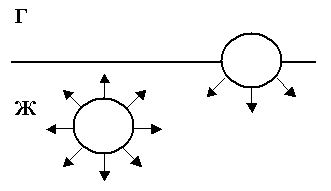 2.2
Поверхностные явления. Рассмотрим
молекулу, (рис.), находящуюся в глубине
своей фазы. Такая молекула взаимодействует
со всеми окружающими её молекулами, и
все её энергетические связи насыщены.
У молекулы, расположенной на границе
раздела фаз, насыщены только те связи,
которые направлены вглубь ее фазы. Такая
молекула обладает избыточной потенциальной
энергией. Свободная поверхность жидкости
или твёрдого тела обладает избытком
поверхностной энергии. Как любая система,
дисперсные системы стремятся понизить
избыточную энергию, что возможно путем
уменьшения площади поверхности раздела
фаз, т.е. укрупнения частиц. Слияние
частиц дисперсной фазы и их укрупнение
называется коагуляцией.
Укрупнённые частицы под действием
собственной тяжести начинают выпадать
в осадок. Этот процесс медленный и носит
название седиментации.
В результате образуется истинный
раствор, содержащий осадок. Дисперсная
система перестаёт существовать. Данный
путь понижения поверхностной энергии
ведёт к разрушению дисперсной системы.
2.2
Поверхностные явления. Рассмотрим
молекулу, (рис.), находящуюся в глубине
своей фазы. Такая молекула взаимодействует
со всеми окружающими её молекулами, и
все её энергетические связи насыщены.
У молекулы, расположенной на границе
раздела фаз, насыщены только те связи,
которые направлены вглубь ее фазы. Такая
молекула обладает избыточной потенциальной
энергией. Свободная поверхность жидкости
или твёрдого тела обладает избытком
поверхностной энергии. Как любая система,
дисперсные системы стремятся понизить
избыточную энергию, что возможно путем
уменьшения площади поверхности раздела
фаз, т.е. укрупнения частиц. Слияние
частиц дисперсной фазы и их укрупнение
называется коагуляцией.
Укрупнённые частицы под действием
собственной тяжести начинают выпадать
в осадок. Этот процесс медленный и носит
название седиментации.
В результате образуется истинный
раствор, содержащий осадок. Дисперсная
система перестаёт существовать. Данный
путь понижения поверхностной энергии
ведёт к разрушению дисперсной системы.
Второй путь понижения поверхностной энергии -сорбция. Сорбция - это поглощение одного вещества другим. Поглотитель - сорбент, поглощаемое вещество - сорбат. Если поглощение происходит только в поверхностном слое сорбента, т.е. происходит поверхностная сорбция, она называется адсорбцией. Если же сорбат продиффундировал по всему объёму сорбента, т.е. если произошла объёмная сорбция, она называется абсорбцией. По механизму протекания процесса сорбция подразделяется на: физическую, химическую. При физической сорбции между сорбентом и сорбатом происходит только межмолекулярное взаимодействие, т.е. сцепление достаточно непрочное, и со временем начинается обратный процесс - процесс отдачи поглощённого вещества, и в конце концов устанавливается равенство скоростей обоих процессов:Vадсорбции == Vдесорбции. При химической сорбции (хемосорбции) между сорбентом и сорбатом возникает химическое взаимодействие, в результате чего между ними образуется третье вещество, рис.2.
Х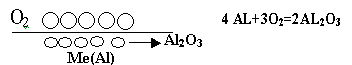 имическая
сорбция намного прочнее физической,
десорбция самопроизвольно практически
не происходит. Ещё одно отличие между
физической и химической сорбцией
заключается в том, что при повышении
температуры физическая сорбция
уменьшается, а химическая увеличивается.
В чистом виде физическая и химическая
сорбция встречаются редко, чаще всего
сорбция включает элементы их обеих.
имическая
сорбция намного прочнее физической,
десорбция самопроизвольно практически
не происходит. Ещё одно отличие между
физической и химической сорбцией
заключается в том, что при повышении
температуры физическая сорбция
уменьшается, а химическая увеличивается.
В чистом виде физическая и химическая
сорбция встречаются редко, чаще всего
сорбция включает элементы их обеих.
Вещества, понижающие поверхностное натяжение, называются поверхностно-активными (ПАВ). К ПАВ относятся органические вещества, молекулы которых состоят из участков с резко различными свойствами. Одна часть молекул – полярная группа, другая – неполярная часть, состоящая из углеводородного радикала. К полярным группам относятся –ОН, -СООН, -NН2, -SО2Н и др. ПАВ. Молекулы ПАВ’а менее полярны, чем молекулы воды. Благодаря этому взаимодействие молекул воды между собой сильнее, чем молекул воды с молекулами ПАВ’а. В результате молекулы ПАВ’а будут вытесняться из раствора в поверхностный слой. Повышение концентрации третьего вещества в поверхностном слое, в частности, молекул ПАВ’а, приводит к понижению поверхностного натяжения.
3.Классификация коллоидных систем. Коллоидное сотояние характерно для многих веществ, если их частицы имеют размер от 1 до 500 нм. Суммарная поверхность этих частиц огромна. Характерной особенностью коллоидных частиц является наличие на их поверхности заряда. обусловленного избирательной адсорбцией ионов.. Существуют лиофильные (гидрофильные коллоиды, в которых растворитель взаимодействует с ядрами частиц, и лиофобные (гидрофобные) коллоиды, в которых растворитель не взаимодействует с ядрами частиц. Золями называют такие коллоидно - дисперсные системы, в которых дисперсионной средой (т.е. растворителем) является вода. Золи подразделяются на: гидрофильные; гидрофобные. Гидрофильные золи образуются такими веществами, как крахмал, желатин, яичный желток и белок и многие краски. Приготовление гидрофильных золей не требует специальных методов. В гидрофильных золях вода играет двоякую роль: она является одновременно растворителем и стабилизатором. Молекулы воды, гидратируя частицы дисперсной фазы, не позволяют им подходить друг к другу и слипаться, т.е. они препятствуют процессу коагуляции. В этом заключается стабилизирующая роль воды. Гидрофобные золи образуются такими веществами, как трудно растворимые гидроксиды и соли, металлы, а также многие органические вещества.
4. Получение коллоидных растворов. Методы подразделяются на физические и химические. И физические, и химические методы подразделяются на: дисперсионные, т.е. разукрупняющие; конденсационные, т.е. укрупняющие. Физическая конденсация может осуществляться из паров или путем замены растворителя. Конденсация из паров основана на одновременной конденсации паров диспергируемого вещества и растворителя на холодной поверхности. Таким образом получают гидрозоли металлов. Метод замены растворителя основан на изменении состава и свойств дисперсионной среды и заключается в том, что истинный раствор вещества добавляется к жидкости, смешивающейся с растворителем, но в которой само вещество мало растворимо и выделяется в виде высокодисперсной фазы. Химические методы получения гидрофобных золей основываются на реакциях: обмена; гидролиза; окисления – восстановления.
5.Мицеллы и их строение. Строение коллоидной частицы рассмотрим на примере образования коллоидной частицы AgCl, происходящего в результате реакции
AgNO3 + KCl = AgCl↓ + КNO3
Молекулы AgCl объединяются в практически нерастворимые дисперсные частицы, в которых ионы Ag+ и Cl- образуют кристаллическую решетку.Если AgNO3 и KCl взяты в эквивалентных количествах, то частицы-кристаллики растут, достигая значительной величины, превосходящей размеры коллоидных частиц, и быстро выпадают в осадок.
Если одно из исходных веществ (например, AgNO3) взято в небольшом избытке, то оно служит стабилизатором, сообщающим устойчивость коллоидным частицам. Построение кристаллической решетки AgCl может идти только за счет ионов, входящих в ее состав; в данном случае за счет ионов Ag+. Ионы Ag+ будут продолжать достраивать кристаллическую решетку ядра, прочно входя в его структуру и сообщая ему электрический заряд. В связи с этим ионы, достроившие кристаллическую решетку ядра, называются потенциалопределяющими ионами. Величина электрического заряда у многих коллоидных частиц достигает 1 в. Частицы с таким относительно высоким зарядом будут притягивать оставшиеся в растворе противоположно заряженные (называемые поэтому противоионами) ионы NO3-. Начнется процесс адсорбции противоионов, в результате которого установится динамическое равновесие между адсорбированными и свободными ионами. Основная часть всех противоионов, адсорбированная на ядре коллоидной частицы, образует вместе с потенциалопределяющими ионами адсорбционный слой. Ядро и адсорбционный слой вместе составляют гранулу. Остаток противоионов удерживается электростатическими силами притяжения вблизи гранулы, образуя диффузный слой. Таким образом, на коллоидной частице возникает двойной электрический слой (ДЭС), состоящий из ионов на поверхности (потенциалопределяющих ионов) и из компенсирующих заряд поверхности ионов (противоионов) в растворе; причем часть противоионов находится в прилегающем к поверхности и прочно связанном с ней адсорбционном слое, а другая часть – в диффузном слое, удаленном от поверхности. Частица дисперсной фазы вместе с диффузным слоем образует электронейтральную мицеллу.
Строение мицеллы золя AgCl, стабилизированного AgNO3, можно представить в виде формулы:
{n[AgCl]mAg+(m-x)NO3-}х+· х NO3-,
где n – число молекул, образующих дисперсную частицу; m – число потенциалопределяющих ионов; (m-x) – число противоионов адсорбционного слоя; х – число противоионов диффузного слоя.
Если золь хлорида серебра стабилизирован хлоридом калия, то строение его мицеллы будет выглядеть следующим образом:
{n[AgCl]mCl-(m-x)К+}х-· х К+.
Оптические свойства золей. Золи отличаются от истинных растворов визуально, с помощью так называемого конуса Тиндаля. Если на плоскопараллельную кювету,заполненную истинным раствором, направить узкий луч видимого света, то будут видны точки входа и выхода луча. Ход луча в растворе не будет виден. В силу того, что частицы растворённого вещества несоизмеримо меньше длины волны луча, луч проходит через раствор,"не замечая" эти частицы, поэтому его ход и не виден. Если такой луч направить на кювету с золем, рис.9, то ход луча будет виден в виде светящегося конуса голубоватого цвета. Размер частиц дисперсной фазы меньше длины волны луча по меньшей мере в 10 раз. Но в данном случае луч "замечает" эти частицы и огибает их. Происходит явление дифракции, в результате чего и возникает этот конус.
Электрические свойства золей. Рассмотрим мицеллу золя в разрезе, рис.10.
|
Рис.10 |
На границе определяющих ионов и противоионов возникает потенциал φ, равный ≈ 1В.На границе гранулы и диффузионного слоя возникает ещё один потенциал ζ, так называемый дзета - потенциал, величина которого не превышает 0,1В. |
Если к раствору гидрофобного золя подвести постоянное напряжение, то мицелла разорвётся по ζ - потенциалу. Гранула мицеллы пойдёт к одному электроду, в соответствии со своим зарядом, а диффузионный силой, увлекая за собой прилежащие к нему слои воды, - к другому электроду.Перемещение гранулы к электроду называется электрофорезом.Перемещение диффузионного слоя с прилежащими слоями воды называется электроосмосом. Поскольку диффузный слой содержит мало вещества, то его отложение на электроде было обнаружено недавно, когда появились точные методы. Тем не менее ζ - потенциал очень важен для существования гидрофобных золей.
6.Устойчивость и разрушение коллоидных систем. В термодинамически неустойчивых коллоидных системах непрерывно протекают самопроизвольные процессы, ведущие к укрупнению частиц. Оно возможно двумя путями: 1) за счет перекристаллизации; 2) за счет слипания частиц в более крупные агрегаты (коагуляции или коалесценции). Перекристаллизация идет медленнее. Коагуляция протекает быстрее. Ее можно вызвать понижением температуры, кипячением, встряхиванием. Все электролиты способны коагулировать коллоидные системы в определенных концентрациях. Коагулирующим является ион, по знаку противоположный заряду частицы. Стабилизирующую роль играют заряды диффузионного слоя.
Разрушающее действие постороннего электролита заключается в том, что однозарядный ион вытесняет противоионы диффузионного слоя в адсорбционный слой. уменьшается заряд диффузного слоя. уменьшается заряд гранулы. В конечном счёте уменьшается ζ - потенциал. С уменьшением ζ - потенциала мицеллы начинают терять свою защиту и слипаются. Когда слипание частиц достигает такого предела, что становится заметным помутнение раствора, соответствующая этому состоянию величина ζ - потенциала носит название – порог коагуляции. Состояние, при котором ζ - потенциал становится равным нулю, называется изоэлектрическим состоянием. При изоэлектрическом состоянии коагуляция идёт полным ходом.

