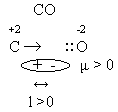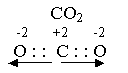- •3. Фактор эквивалентности. Эквивалентные массы и эквивалентные объемы.
- •3.1Фактор эквивалентности химического элемента х в его соединениях равен:
- •3.2.Фактор эквивалентности вещества х, участвующего в окислительно-восстановительном процессе, равен:
- •3.3.Фактор эквивалентности вещества х, участвующего в ионообменном процессе, равен:
- •5.Применение закона эквивалентов.
- •1. Состав атома
- •Характеристики основных частиц, составляющих атом
- •3. Ядерные реакции
- •5. Атомные орбитали. Квантовые числа..
- •6. Законы, определяющие положение электронов в атоме
- •7. Порядок заполнения атомных орбиталей.
- •Упражнения:
- •1.Периодический закон д. И. Менделеева
- •2. Свойства атомов химических элементов.
- •2.3. Характеристика кислородных соединений элементов. Элементов.
- •2.3.1. Состав соединений.
- •2.3.2. Кислотно-основные свойства соединений.
- •2.3.3. Окислительно-восстановительные свойства соединений.
- •3.Периодическая система элементов д. И. Менделеева.
- •3.2.Группы таблицы Менделеева
- •3.3. Периодичность изменения свойств элементов.
- •Упражнения:
- •4.3. Составление структурных формул молекул.
- •4.4.Ионная связь и ее свойства
- •4.5. Водородная связь и ее свойства.
- •Определение типа и свойств связи в молекуле.
- •Составление структурных формул соединений Упражнения:
- •5.2.Донорно–акцепторный механизм ковалентной связи
- •5.3.Комплексные соединения.
- •Ответы.
- •Лекция 7. Термохимия
- •1. Предмет и основные понятия химической термодинамики.
- •7.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
- •Задачи.
- •8.3. Химический потенциал. Активность и коэффициент активности. Условия химического равновесия.
- •8.1. Химический потенциал. Активность и коэффициент активности.
- •8.4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
- •Упражнения.
- •9.5. Фазовое равновесие. Правило фаз.
- •Фазовая диаграмма воды
- •9.6.Упражнения для самоконтроля направлены на закрепление умения пользоваться следующими закономерностями:
- •10.6.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Задания
- •7. Произведение растворимости
- •11.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Задания
- •12.7.Упражнения для самоконтроля направлены на закрепление знаний в области:
- •Лекция 13. Органические полимерные материалы. Органические полимерные материалы. Методы получения полимеров, полимеризация, поликонденсация. Строение и свойства полимеров. Применение полимеров.
- •Наиболее часто встречающиеся синтетические полимеры
- •14.3.Электродные потенциалы активных и пассивных металлов
- •Термодинамика гальванического элемента.
- •14.6.Потенциал редокси-электродов.
- •14.5.Упражнения для самоконтроля направлены на закрепление знаний в области расстановки коэффициентов в уравнениях овр, электродных потенциалов, гальванических элементов.
- •17.1 Классификация методов анализа.
3.2.Группы таблицы Менделеева
Таблица Д.И. Менделеева состоит из 8 групп. Физический смысл номера группы заключается в том, что номер группы соответствует валентности входящих в него элементов. Если элемент обладает переменной валентностью, то номер группы соответствует наивысшей валентности данного элемента. Каждая группа делится на главную (А) и побочную (В) подгруппу. Главная подгруппа содержит элементы и малых, и больших периодов (S и p - элементы). Побочные подгруппы включают в себя d и f – элементы, т.е. элементы только больших периодов. Элементы, составляющие одну подгруппу, имеют близкие химические свойства, т.к. имеют сходные валентные окончания. Химические свойства элементов обуславливаются их валентными окончаниями. Валентное окончание элемента зависит от его положения в таблице Менделеева. Все элементы одной подгруппы имеют одинаковую конфигурацию валентных окончаний, но разные квантовые числа.
С увеличением главного квантового числа у элементов данной подгруппы усиливаются металлические свойства, что обусловлено, в первую очередь, увеличением промежуточных электронных слоёв между ядром атома и его валентным слоем. Элементы, составляющие одну группу, но разные подгруппы, имеют различные валентные окончания и различные химические свойства.
|
17Cl |
3S23p5 |
25Mn |
3d54S1 |
|
активный неметалл |
металл средней активности |
||
Элементы, составляющие одну группу, имеют одинаковую валентность. В случае переменности валентности общей является наивысшая валентность.
|
1, 3, 5, 7 |
2, 3, 4, 5,6, 7 |
|
+7 |
+7 |
|
HClO4 |
HMnO4 |
|
хлорная кислота |
марганцовая кислота |
3.3. Периодичность изменения свойств элементов.
Следующие свойства элементов являются периодическими:
-
металличность и связанная с ней восстановительная способность;
-
энергия ионизации;
-
неметалличность и связанная с ней окислительная способность;
-
сродство к электрону;
-
электроотрицательность;
-
атомные радиусы.
Свойства, не имеющие периодичности :
-
заряд ядра;
-
атомная масса.
Периодический характер изменения имеют не только элементы, но и их соединения. Оксиды элементов, расположенных в начале периодов ( Li2O; Na2O; MgO), имеют основный характер. Затем идут амфотерные оксиды (BeO, Al2O3). Элементы, расположенные во второй половине, имеют кислотный характер (CO2, NO2, SiO2).
4.Упражнения для самоконтроля направлены на закрепление следующих понятий:
-
изменение свойств элементов и их соединений по периоду и группе.
-
Составление химических формул соединений
-
Составление уравнений химических реакций
Упражнения:
-
Атом, какого элемента имеет наибольший радиус?
а ) С б ) В в ) О г ) F
-
У какого из перечисленных элементов наибольшее сродство к электрону?
а ) О б ) S в ) Se г ) Те
-
Какой из гидроксидов проявляет наиболее сильные основные свойства? а)Be(OH)2 б)LiOH в)Mg(OH)2 г)NaOH
-
Для какого элемента справедливо уравнение реакции:
ЭО3 + Н2О ↔ Н2ЭО4
-
а ) Р б ) I в ) С г ) S
-
С какими из ниже перечисленных веществ будет реагировать серная кислота, Напишите уравнения реакций: 1) SO2, 2)ZnO, 3)Mg, 4) Ba(OH)2, 5) HCl, 6) Fe2O3, 7) P2O5
-
Ответы: 1- б ) В; 2- а ) О; 3- г)NaOH; 4- г ) S; 5-2)ZnO, 3)Mg, 4) Ba(OH)2, , 7) Fe2O3.
-
Уравнения реакций:
2)ZnO + H2SO4 = Zn SO4 + H2О
3)Mg+ H2SO4 = Mg SO4 + H2
4) Ba(OH)2+ H2SO4 = ВаSO4 + 2H2О
7) Fe2O3+ 3H2SO4 = Fe2 (SO4)3+ 3H2О
Лекция 4. Химическая связь
Основные виды химической связи. Ковалентная связь и ее свойства . Ионная связь и ее свойства. Водородная связь и ее свойства. Комплементарность. Металлическая связь и ее свойства.
4.1. Основные виды химической связи. Под химической связью понимают результат взаимодействия двух и более атомов, приводящий к образованию устойчивой многоатомной системы.
Важнейшими видами химической связи являются: ковалентная, ионная водородная, металлическая, межмолекулярная.
4.2. Ковалентная связь и ее свойства.
Ковалентная связь является наиболее
универсальной в том плане, что ей
подчиняется подавляющее большинство
веществ как органических, так и
неорганических. Суть ковалентной связи
по методу валентных связей (ВС) заключается
в том, что атомы, объединяя свои неспаренные
валентные электроны с антипараллельными
спинами в общую электронную пару,
образуют более сложную частицу.
 .
.
Электронную пару по методу ВС обозначают двумя точками или чёрточкой - валентным штрихом. Ковалентная связь имеет пять основных свойств:
1. Энергия связи – выделенная атомами потенциальная энергия при образовании ими более сложных частиц. При сближении двух атомов водорода максимально выделяется 435 кДж/моль. Это и является энергией молекулы водорода. Такой энергии соответствует максимально прочная молекула водорода. Энергия ковалентной связи лежит в пределах 150 ÷ 1000 кДж/моль. Чем выше энергия, тем прочнее частица.
![]() =150кДж/моль
=150кДж/моль
![]() =435кДж/моль
=435кДж/моль
![]() =
970 кДж/моль.
=
970 кДж/моль.
2. Длина
связи – расстояние
между центрами двух атомов, которое
соответствует максимально потерянной
потенциальной энергии, и сложная частица
является наиболее прочной. Таким образом,
длина связи тесно связана с энергией.
Для атома водорода длина связи составляет
0,74
![]() .
Это означает, что два атома Н2
не просто соприкасаются, а частично
перекрывают друг друга. Область перекрытия
показывает место нахождения общей
электронной пары и называется областью
повышенной электрической плотности.
.
Это означает, что два атома Н2
не просто соприкасаются, а частично
перекрывают друг друга. Область перекрытия
показывает место нахождения общей
электронной пары и называется областью
повышенной электрической плотности.
3. Полярность. Ковалентные частицы могут быть полярными и неполярными. Полярная ковалентная связь возникает в том случае, если частица образованна атомами с различными электроотрицательностями. В молекуле возникают два поля – диполи (+ ; -), между которыми есть какое-то расстояние. Диполь определяется дипольным моментом, который равен заряду электрона, умноженному на дипольное расстояние: μ = е • l. Размерность дипольного момента Кулон/метр (Кл/м). Чем больше разница между электроотрицательностью элементов, тем больше дипольный момент сложной частицы, т.е. тем полярней диполь. Неполярная ковалентная связь возникает в том случае, если частица образуется атомами с одинаковой электроотрицательностью. В ковалентных неполярных частицах общая электронная пара принадлежит одинаково ядрам обоих атомов.Расстояние между "+" и "–" равно нулю. Дипольный момент тоже равен нулю. Полярность связи и полярность частиц не всегда совпадают между собой.
|
|
|
|
Полярность – векторная величина. Вектор всегда направлен от менее электроотрицательных элементов к более электроотрицательным элементам. В молекуле СО2 два вектора, равные по величине, но противоположные по направлению, компенсируют друг друга, и молекула оказывается неполярной при полярной связи.
4. Насыщаемость ковалентной связи заключается в том, что все неспаренные валентные электроны обязаны участвовать в образовании сложных частиц. 5. Направлентность ковалентной связи заключается в том, что ковалентные частицы имеют определённую пространственную конфигурацию. Пространственная конфигурация отдельной частицы определяется количеством σ – связей и их взаимным расположением в пространстве. σ- связями называются связи, у которых область повышенной электрической плотности располагается на линии, связывающей ядра двух атомов. σ – связь - это первичная связь. Она является прочной и трудно разрывается. π – связью называется та связь, при которой обе повышенные электрические плотности располагаются выше и ниже линии, связывающей ядра двух атомов. π – связь всегда вторична и менее прочна, чем σ – связь. При образовании молекулы водорода перекрываются 2S – облака, и образуется одна σ – связь. Возникает линейная молекула с нулевым валентным углом.
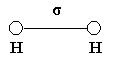
Такие же частицы, т.е. линейные с нулевым валентным углом, образуются при перекрывании двух рх – облаков, при образовании, например, молекул хлора или фтора. Такие же частицы образуются при перекрывании S- и p-облаков (например, HCl). Рассмотрим элемент шестой группы таблицы Менделеева - кислород.
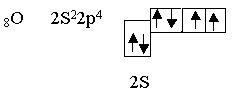 .
.
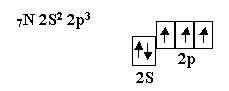
Кислород является центральным атомом в молекуле воды. Из шести валентных электронов атомов кислорода - два неспаренных. в пространстве возникают две σ–связи, расположенные друг к другу под теоретическим углом 90°. В молекуле воды угол равен 105°, но это вызывается дополнительными причинами. Азот, элемент пятой группы таблицы, имеет следующее валентное окончание:
 .
.
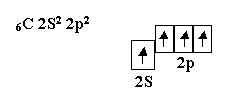
Атом азота имеет три неспаренных электрона, которые участвовуют в образовании частиц, например, NH3.Три σ – связи, расположенные под углом 90° по отношению друг к другу, приводят к образованию молекулы, имеющей форму треугольной пирамиды с валентными углами 90° Углерод, элемент четвёртой группы таблицы, в возбуждённом состоянии имеет четыре неспаренных электрона и проявляет валентность, равную четырём
 .
.
Электроны, находящиеся в S- и в p-состояниях,
не равноценны между собой, так как имеют
разную конфигурацию и различный запас
потенциальной энергии. Чтобы образовать
равноценные связи, эти электроны должны
гибридизироваться. Гибридизация
электронов происходит по форме
и энергии. S- и р – облака образуют
гибридные – облака В атоме
углерода происходит SP3
– гибридизация, которая приводит к
образованию четырёх гибридных q –
электронов: SP3
![]() q4
.
q4
.
Четыре равноценных q – электрона образуют четыре равноценные σ – связи, например, в молекуле метана CH4. Такие молекулы (CH4, CCl4 и т.д.) имеют пространственную конфигурацию - тетраэдр с валентными углами 109°28'.
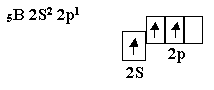
Бор, элемент третьей группы таблицы Менделеева, имеет вапентное окончание :
 .
.
В молекуле BCl3 все три связи должны быть образованы равноценными электродами, поэтому валентные электроны атома бора подвергаются гибридизации. В данном случае, SP2 -гибридизации, в результате которой образуются три гибридных q-электрона.
SP2
![]() q3
q3
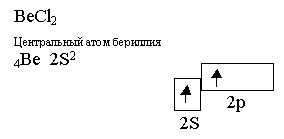
Молекула BCl3 имеет в пространстве конфигурацию плоского треугольника с валентными углами120°. Элемент второй группы, бериллий, образует сложные частицы только в возбуждённом состоянии:
 .
.
Валентные электроны атома бериллия подвергаются Sp – гибридизации, в результате которой образуется два гибридных q – электрона.
SP![]() q2
q2
Два гибридных q – электрона, перекрываясь, образуют две σ – связи. В результате образуется линейная молекула с валентным углом 180°.