
- •Конспект лекцій з курсу
- •Лекція № 1. Значення курсу та його роль у становленні інженера хіміка-технолога.
- •Лекція № 2. Енергетико-магістральний напрямок соціально-економічного розвитку суспільства.
- •Лекція № 3
- •Лекція № 4
- •Лекція 11 ступінь термодинамічної досконалості технічних процесів
- •Лекція № 12. Розрахунок ексергії
- •Лекція № 13. Методика розрахунку ексергії
- •Лекція № 14. Основні положення термодинамічного аналізу хімічних процесів
- •Лекція № 15 процеси горіння рідкого і газоподібного палива. Ексергетичний і термічний ккд.
- •Лекція № 6. Другий закон термодинаміки
- •Лекція 8 процеси зміни стану газа
- •Лекція 9 поняття максимального коефіцієнта корисної дії
- •Лекція 10 ексергетичний метод термодинамічного аналізу
- •Лекція № 12. Розрахунок ексергії
- •Лекція № 13. Методика розрахунку ексергії
- •Лекція № 14. Основні положення термодинамічного аналізу хімічних процесів
- •Лекція № 15 процеси горіння рідкого і газоподібного палива. Ексергетичний і термічний ккд.
- •Термодинамічний аналіз теплообмінних процесів
- •Лекція № 18 вторинні енергетичні ресурси (вер) і способи утилізації теплоти технологічних виробництв.
Лекція № 14. Основні положення термодинамічного аналізу хімічних процесів
|
14.1. |
Ексергетичні ККД різних технічних систем |
|
|
14.2 |
Сутність характерних схем хімічних виробництв |
|
|
14.3 |
Взаємозв'язок утрат ексергії |
|
-
Перше завдання ексергетичного аналізу полягає в розрахунку ексергетичних ККД. Їх величина відбиває ступінь термодинамічної досконалості процесу, або, те ж саме, ступінь кваліфікованого використання енергії в ході процесу. Зіставлення ККД різних процесів почасти відбиває рівень їхньої технічної досконалості. Однак це зіставлення трохи умовне, тому що величина ККД залежить від рівнів відліку ексергії, а також від того, який варіант ККД знаходили в даному випадку. У такий спосіб зіставляючи значення ККД, розраховані різними авторами для різних процесів, варто враховувати, яким шляхом були знайдені їхні значення. Нижче приведені ексергетичні ККД різних технічних систем:
Таблиця
|
|
ККД, % |
|
|
Виробництво азотної кислоти |
9 |
|
|
Сонячний елемент на основі кремнію |
12 |
|
|
Електроліз NaCl з одержанням NaOH і Cl2 |
13 |
|
|
Автомобіль |
18 |
|
|
Виробництво H2SO4 |
23 |
|
|
Виробництво вінілхлориду |
36 |
|
|
Електростанція |
40 |
|
|
Виробництво формальдегіду |
47 |
|
|
Синтез стиролу |
55 |
|
|
Синтез аміаку |
55 |
|
|
Синтез метанолу |
61 |
|
|
Виробництво етилену |
78 |
|
З цих даних видно, що термодинамічна ефективність хімічних процесів досить різна і коливається від 9 до 78%.
Якщо правомірно порівняння з виробництвом електроенергії (е=40%), то напрошується висновок, що такі великотоннажні енергоємні процеси, як виробництво азотної і сірчаної кислот, а також їдкого натру і хлору досить недосконалі з позицій енергетики. Однак, цей висновок необхідно підтвердити більш детальним аналізом, головною задачею якого є пошук причин енергетичних втрат і раціональних способів їхнього зменшення. Для цього доцільно розподілити втрати по стадіях виробництва (на першому етапі без обліку їхнього взаємозв'язку).
На Мал.1. приведена в спрощеному виді характерна схема хімічного виробництва. Хімічна переробка сировини здійснюється в реакторі 1. Якщо протікає ендотермічна реакція, то до реагенту підводиться тепло, якщо реакція екзотермічна, тепло може виводитися або в зоні реакції, або на виході з реактора.


 4б
4б





 3
3


 1
1











 4а
4а


 2а
2а




2б
У будь-якому випадку енергія продуктів реакції, що виходять з реактора при підвищеній температурі, використовується в апараті 2а. Якщо ж реактор обігрівається через стінку, то необхідно утилізувати енергію в апараті 2б.
Реакційна суміш, що містить як цільові продукти реакції, так і ті вихідні речовини, що не прореагували, а також продукти побічних реакцій, надходить на поділ в апарат 3, відкіля відбирається цільовий продукт і сировина, що не прореагувала. У реальних схемах подібні процеси можуть зустрічатися багаторазово, причому вони бувають доповнений стадіями підготовки сировини (очищення, поділ), аналогічними очищенню суміші, що ре циркулює, від продуктів побічних реакцій.
З приведеної схеми видно, що всі процеси хімічного виробництва можна розділити на чотири групи: хімічні процеси (апарат 2); процеси рекуперації тепла (апарати 2 – котли-утилізатори, теплообмінники, кип'ятильники, холодильники і т.п.); процеси поділу й очищення (апарат 3), наприклад процеси абсорбції, адсорбції, ректифікації, екстракції, кристалізації, сушіння і т.п., а також процеси стиску, розширення і перекачування газів і рідин (апарати 4 – насоси, компресори, турбіни й інші).
Одна з перших цілей аналізу полягає у виявленні того, які з перерахованих вище чотирьох видів процесів приводять до найбільших утрат.
-
Між утратами ексергії існує деякий зв'язок. Проілюструємо цей зв'язок на найпростішому прикладі, що зводиться до наступного (див. Мал.2.)
I


 4 5
4 5
1
2 3

Мал.2. Утрати ексергії при виробництві тепла (водяної пари) і холоду.
1 – система, що споживає тепло і холод; II – паровий котел (e1=0.8), ІІІ – турбіна (e2=0.66); ІУ – холодильна машина (e3=0.25); 1 – паливо, 875 одиниць ексергії; 2 – водяна пара, 600 одиниць ексергії; 3 – електроенергія, 400 одиниць ексергії; 4 – водяна пара, 100 одиниць ексергії; 5 – хладоагент, 100 одиниць ексергії.
Система 1 споживає тепло (водяну пару) у кількості 100 одиниць ексергії і холод (хладоагент) – також 100 одиниць ексергії. Водяна пара виробляється з палива 1 у котлі П, що працює з e1=0.8. Щоб одержати холод у холодильній машині 1У, затрачається електроенергія з ККД e= 0,25, що виробляється в турбіні ІІІ з e2=0.66, що працює на водяній парі.
На цьому прикладі можна проілюструвати ряд важливих положень ексергетичного аналізу. При формальному підході до удосконалення системи 1, тобто без обліку всіх її взаємозв'язків зі стадіями перетворення енергії вихідного палива, байдуже який вид витрат ексергії варто зменшувати в першу чергу – витрати холоду або витрати тепла, тому що скорочення їхніх витрат на 10 одиниць ексергії на перший погляд дає однаковий ефект. Однак приведені на Мал.2. дані показують, що цей висновок абсолютно невірний. Облік взаємозв'язків у системі приводить до іншого результату. Водяна пара виробляється на початку технологічного ланцюжка з e=0,8. Отже, на 10 одиниць ексергії пари потрібно затратити 10/e1=10/0.8=12.5 ед ексергії палива. Якщо ж заощадити 10 одиниць ексергії холоду, то економія ексергії палива складе 10/e1,e2,e3=10/0,25*0,66*0,8=75 одиниць ексергії палива. Таким чином, і енергетичний, і економічний ефект при економії холоду вище, ніж при економії тепла в
![]() =6,1
рази. Помилка в оцінці ефективності
економії холоду і тепла могла бути (у
залежності від «потенціалу» тепла і
холоду) ще більше, якби потоки тепла і
холоду вимірялися не в одиницях ексергії,
а в одиницях енергії. Отже, чим далі від
початку ланцюжка, тобто від первинного
джерела енергії, знаходиться споживач
енергії, тим більший ефект дає її
економія. У підсумку, економія в котельні,
безсумнівно, важлива, але набагато
важливіше заощаджувати енергію в
споживача, - наприклад, на хімічному
заводі. Так, одна одиниця енергії,
заощадженої в обробній промисловості
, дозволяє скоротити потроєну кількість
первинної енергії (нафти, газу). Таким
чином, у ході ексергічного аналізу поряд
зі значенням утрат ексергії і ККД окремих
стадій, необхідно також знати їх
«родовід», тобто скільки «первинної»
ексергії треба затратити, що виробити
даний потік ексергії.
=6,1
рази. Помилка в оцінці ефективності
економії холоду і тепла могла бути (у
залежності від «потенціалу» тепла і
холоду) ще більше, якби потоки тепла і
холоду вимірялися не в одиницях ексергії,
а в одиницях енергії. Отже, чим далі від
початку ланцюжка, тобто від первинного
джерела енергії, знаходиться споживач
енергії, тим більший ефект дає її
економія. У підсумку, економія в котельні,
безсумнівно, важлива, але набагато
важливіше заощаджувати енергію в
споживача, - наприклад, на хімічному
заводі. Так, одна одиниця енергії,
заощадженої в обробній промисловості
, дозволяє скоротити потроєну кількість
первинної енергії (нафти, газу). Таким
чином, у ході ексергічного аналізу поряд
зі значенням утрат ексергії і ККД окремих
стадій, необхідно також знати їх
«родовід», тобто скільки «первинної»
ексергії треба затратити, що виробити
даний потік ексергії.
Для обліку взаємозв'язку втрат ексергії використовуються поняття: «прямі» утрати – це втрати, що виникають безпосередньо на розглянутій стадії, «побічні» утрати – це втрати на наступних стадіях, що виникають через недосконалість розглянутої стадії. Наприклад, неповне протікання хімічної реакції може знизити втрати ексергії на цій стадії, але приведе до збільшення втрат при поділі суміші на наступних стадіях, а також до втрат продукції внаслідок отруєння каталізаторів і т.п. До непрямих утрат відносять утрати нетехнологічного характеру, що залежать від утрат на розглянутій стадії (при утилізації тепла топкових газів при обігріві реакторів і т.п.). У загальному виді можна записати, що зміна загальних утрат ексергії в системі d(E) - це сума добутків часток похідних від загальних утрат ексергії E по втратах у даній стадії Ei, помножених на втрати на цій стадії.
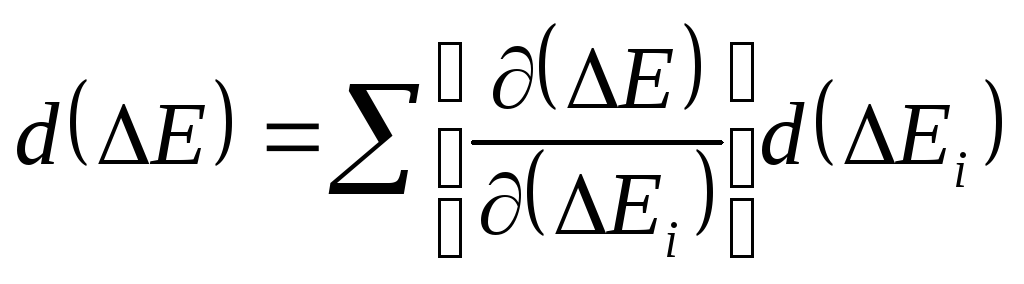
Іншими словами, для кожного конкретного процесу необхідно знати функціональні зв'язки між загальними втратами ексергії і втратами ексергії на його окремих стадіях. Останні, у свою чергу, залежать від параметрів технологічного режиму. Наявність складних прямих і зворотних зв'язків приводить до необхідності вести оптимізацію процесу з використанням ЕОМ.
