
- •Конспект лекцій з курсу
- •Лекція № 1. Значення курсу та його роль у становленні інженера хіміка-технолога.
- •Лекція № 2. Енергетико-магістральний напрямок соціально-економічного розвитку суспільства.
- •Лекція № 3
- •Лекція № 4
- •Лекція 11 ступінь термодинамічної досконалості технічних процесів
- •Лекція № 12. Розрахунок ексергії
- •Лекція № 13. Методика розрахунку ексергії
- •Лекція № 14. Основні положення термодинамічного аналізу хімічних процесів
- •Лекція № 15 процеси горіння рідкого і газоподібного палива. Ексергетичний і термічний ккд.
- •Лекція № 6. Другий закон термодинаміки
- •Лекція 8 процеси зміни стану газа
- •Лекція 9 поняття максимального коефіцієнта корисної дії
- •Лекція 10 ексергетичний метод термодинамічного аналізу
- •Лекція № 12. Розрахунок ексергії
- •Лекція № 13. Методика розрахунку ексергії
- •Лекція № 14. Основні положення термодинамічного аналізу хімічних процесів
- •Лекція № 15 процеси горіння рідкого і газоподібного палива. Ексергетичний і термічний ккд.
- •Термодинамічний аналіз теплообмінних процесів
- •Лекція № 18 вторинні енергетичні ресурси (вер) і способи утилізації теплоти технологічних виробництв.
Лекція № 12. Розрахунок ексергії
|
12.1. |
Зміна ексергії при фізичних і хімічних процесах |
|
|
12.2 |
Термічна складова ексергії |
|
|
12.3 |
Ексергія тиску |
|
|
12.4 |
Хімічна ексергія |
|
-
Методику розрахунку ексергії можна розділити на дві групи. Перша – це розрахунок зміни ексергії при фізичних і хімічних процесах; друга – це визначення рівнів відліку ексергії (або, те ж саме, параметрів навколишнього середовища при розрахунку ексергії). Ця частина методики має принциповий характер, тому що в приведене раніше визначення ексергії входять також такі поняття, як «навколишнє середовище», «навколишнє природне середовище», рівновага. Від правильного трактування цих понять залежить величина ексергії і відповідно результати ексергічного аналізу. Цій проблемі приділяється велика увага, що вказує на складність її рішення, причому ряд моментів дотепер ще відносяться до дискусійних.
-
У загальному випадку збільшення ексергії 1 моля речовини при зміні температури, тиску і складу складає:
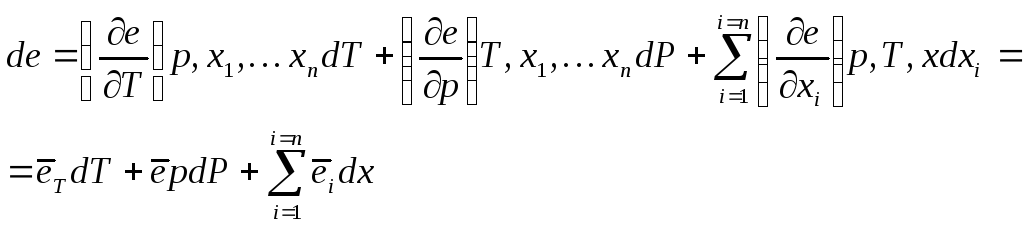 (12.1)
(12.1)
Після інтегрування одержимо
![]() (12.2)
(12.2)
У рівняннях (12.1,
(12.2) величини
![]() - відповідно збільшення эксэргії системи
при зміні її температури, тиску і числа
молів компонента (або мольної частки
xi,
якщо xi=1).
Величину eT
у літературі звичайно називають
«термічною» ексергією (точніше, термічною
складовою ексергії), величину ep
ексергією тиску (або механічної
складової), величину ex
- хімічної ексергією. Суму
eT+ep=eTP
=eфиз
називають
часто термомеханічною або фізичної
ексергією.
- відповідно збільшення эксэргії системи
при зміні її температури, тиску і числа
молів компонента (або мольної частки
xi,
якщо xi=1).
Величину eT
у літературі звичайно називають
«термічною» ексергією (точніше, термічною
складовою ексергії), величину ep
ексергією тиску (або механічної
складової), величину ex
- хімічної ексергією. Суму
eT+ep=eTP
=eфиз
називають
часто термомеханічною або фізичної
ексергією.
У рівнянні (8.1) величина
![]() n1
n1
може бути названа парціальною мольною ексергією і подібно іншим аналогічним властивостям (парціальному мольному обсягові, парціальній мольній ентальпії) означає збільшення ексергії системи даного складу при постійних тисках і температурі внаслідок зміни концентрації і-го компонента. Поняття парціальної мольної ексергії використовується багатьма авторами.
При такому способі розрахунку ексергії складних систем (наприклад, сумішей речовин) можна обійтися без значень ексергії чистих компонентів, але необхідно знати властивості суміші.
В окремих випадках,
наприклад, в ідеальній суміші,
![]() тобто парціальна мольна ексергія
компонент дорівнює ексергії чистого
компонента.
тобто парціальна мольна ексергія
компонент дорівнює ексергії чистого
компонента.
Диференціюючи рівняння Е=Н_ТоS по температурі
![]()
і підставляючи в
нього значення
![]() и
и
![]()
одержуємо
![]()
У підсумку при Ср = const
![]() (12.3)
(12.3)
Рівняння 12.3 відбиває зміну ексергії при нагріванні або охолодженні робочого тіла в умовах Тconst. При постійній температурі (плавлення, випар, конденсація, кристалізація) справедливе відоме рівняння:
![]() (12.4)
(12.4)
-
Ексергія тиску. Диференціюючи рівняння Е = Н-ТоS по тиску
![]()
і підставляючи в нього значення
![]() и
и
![]()
одержимо:
![]() (12.5)
(12.5)
Для розповсюдженої
частки випадку – ідеального газу, коли
PV = RT
– величина
![]() У підсумку
У підсумку
![]() (12.6)
(12.6)
Якщо газова суміш неідеальна й описується рівнянням із другим варіальним коефіцієнтом
![]()
то
![]()
-
Хімічна ексергія. Цю величину доцільно виразити через термодинамічні параметри, які можна знайти в довідковій літературі або при необхідності – експериментально. Зручно виразити ексергію через вільну енергію.
Оскільки е = Н-ТоS і G=H-TS, то
![]() (12.7)
(12.7)
Оскільки з рівняння dG=-SdT+VdP випливає
![]() (12.8)
(12.8)
то
![]() (12.9)
(12.9)
![]() (12.10)
(12.10)
У ряді випадків ексергію можна виразити через ентальпію і вільну енергію. Виключаючи із рівнянь для ексергії і вільної енергії ентальпію, можна одержати
![]() (12.11)
(12.11)
![]() (12.12)
(12.12)
![]() (12.13)
(12.13)
При Т= const
![]() (12.14)
(12.14)
Таким чином, ексергія ( і її втрати) дорівнюють вільній енергії і її втратам, якщо процес протікає при Т=То. При зміні температури втрати ексергії змінюються пропорційно зміні вільної енергії. Значення вільної енергії і ексергії відрізняються тим більше, чим сильніше відхиляється значення Т від То – температура навколишнього середовища. Як видно з рівнянь (12.10), і (12.14), ексергія (і її нарощування) може бути як більше так і менше вільної енергії ( і її збільшення) у залежності від того, чи протікає процес, при Т >То або при Т <То, а також від того, як міняється вільна енергія при зміні температури.
При екзотермічній
реакції зі збільшенням температури
величина G
зростає, тобто
![]() .
У цьому випадку, як випливає з рівнянь
(12.9) і (12.10), чим вище температура Т ( при
Т >То
), тим сильніше змінюється ексергія в
порівнянні зі збитком вільної енергії
(G<0)
, тобто
.
У цьому випадку, як випливає з рівнянь
(12.9) і (12.10), чим вище температура Т ( при
Т >То
), тим сильніше змінюється ексергія в
порівнянні зі збитком вільної енергії
(G<0)
, тобто
![]() .
Відповідно, для ендотермічних реакцій
справедливий протилежний висновок
.
Відповідно, для ендотермічних реакцій
справедливий протилежний висновок
![]() .
Таким чином, рівняння (12.9.) і (12.10) також
підтверджують важливий висновок, що
для зменшення втрат ексергії процес
варто вести в умовах, протилежних
умовам, що забезпечують максимальний
ступінь протікання реакції.
.
Таким чином, рівняння (12.9.) і (12.10) також
підтверджують важливий висновок, що
для зменшення втрат ексергії процес
варто вести в умовах, протилежних
умовам, що забезпечують максимальний
ступінь протікання реакції.
З рівнянь (12.11), (12.12), (12.13) випливає, що якщо процес протікає при Н = 0, то
![]()
Чим нижче температура Т <То, тим вище витрати ексергії в порівнянні зі зміною вільної енергії. Цей випадок характерний для низькотемпературного поділу газових сумішей. Таким чином, той самий процес поділу вимагає при переході до низьких температур значно великих енергетичних витрат.
По вищевказаних
рівняннях, можна, знаючи зміну вільної
енергії в ході реакції, розрахувати
зміну ексергії. Величину
![]() можна визначити одним з відомих способів
(5), наприклад, виходячи з констант
хімічної рівноваги реакції газоподібних
речовин.
можна визначити одним з відомих способів
(5), наприклад, виходячи з констант
хімічної рівноваги реакції газоподібних
речовин.
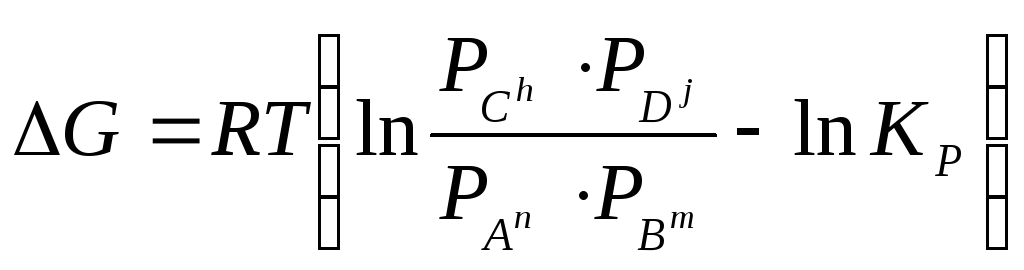
де: pC, pD, pA, pB - парціальні тиски вихідних (А і В) і кінцевих (С, Д) компонентів
суміші;
h, j, n, m - стехіометричні коефіцієнти;
Kp - константа рівноваги
Розрахунок зміни
ексергії при утворенні і поділі сумішей
зручно вести через парціальні мольні
ексергії. Після диференціювання рівняння
(12.11) по числу молів i-го
компонента одержують рівняння, що
характеризують зв'язок
![]() з
хімічним потенціалом
з
хімічним потенціалом
![]()
i - хімічний потенціал i -го компонента.
Можна записати, що
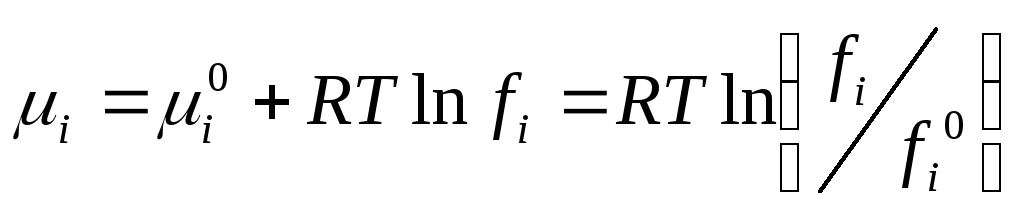
Тому

Таким чином, при xi =1 хімічна складова ексергії дорівнює
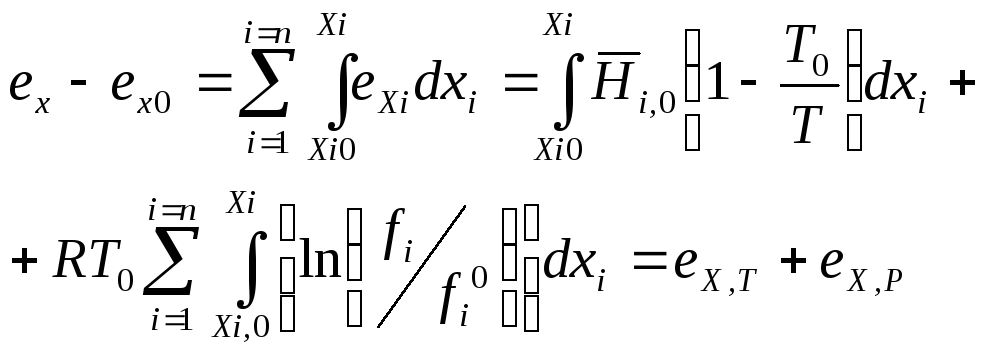 (12.15)
(12.15)
Перший член правої частини рівняння (12.15) відбиває вплив теплоти хімічного або фазового перетворення на ексергію і є аналогом термічної складової ексергії eT. У нього входить інтегральна теплота перетворення Hi
![]() (12.16)
(12.16)
Якщо теплота реакції або фазового переходу затрачається на зміну температури середовища, то рівняння для eT,X не буде відрізнятися від рівняння (12.3) для ет.
Другий член правої частини рівняння (12.15) є аналогом ексергії тиску ер і характеризує залежність ексергії від летючості ( в окремому випадку – від парціального тиску) компонентів системи при зміні її складу. Можна переконатися, що для ідеальної суміші при рівновазі, коли
![]()
Справедливе рівняння
![]() (12.17)
(12.17)
Якщо склад суміші
в ході процесу не зміниться, то рівняння
(12.17) переходить у рівняння
![]()
Таким чином, принципової відмінності в розрахунку зміни хімічної складової ексергії і термомеханічної складової ексергії формально не існує. Розходження полягає лише в тім – враховується або не враховується можливість протікання тієї або іншої хімічної реакції.
При розрахунку зміни ексергії в ході хімічної реакції доцільно використовувати або дані про константи хімічної рівноваги або інші, що дозволяють розрахувати величину G у тих випадках, коли всі ці зведення відсутні, використовують емпіричні способи, розроблені Я.Шаргутом.
Емпіричні способи застосовуються також і в тих випадках, коли реакційні суміші мають складний і перемінний склад і строго описати фазову і хімічну рівновагу неможливо (наприклад, нафта, інші корисні копалини). Викладене вище відноситься до розрахунку зміни ексергії при хімічних і фазових перетвореннях, але не дає можливості розрахувати повне значення ексергії, тому що в усі рівняння входить величина ео. Ця величина дорівнює нулеві в стані, що відповідає умовам відліку ексергії. Якщо для ет і ер цей стан знайти легко, то для ех це представляє деякі складності.
