
- •Общие сведения
- •Требования к выполнению лабораторных работ
- •Форма отчета
- •Обработка результатов измерений Погрешности измерений физических величин
- •Классификация погрешностей измерений
- •Обработка результатов прямых измерений
- •Обработка результатов косвенных измерений
- •Действия с приближенными числами
- •Построение графиков
- •Вывод по графику (шаблон):
- •Измерительные приборы и учет их погрешностей
- •Измерения и обработка результатов
- •Контрольное задание
- •Контрольные вопросы
- •Описание установки и метода измерений
- •Порядок выполнения работы
- •Порядок выполнения работы
- •Контрольные вопросы
- •Библиографический список
- •Определение средней силы удара и коэффициента восстановления при соударении шара с плоской стенкой
- •Описание установки и метода измерений
- •Контрольные вопросы
- •Библиографический список
- •Исследование столкновения шаров
- •Описание установки и метода измерений
- •Проверить закон сохранения импульса
- •Определить среднюю силу удара
- •Порядок выполнения работы
- •Контрольные вопросы
- •Библиографический список
- •Определение скорости пули
- •Определение скорости пули с помощью баллистического маятника Описание установки и метода измерений
- •Порядок выполнения работы
- •Контрольные вопросы
- •Определение скорости пули кинематическим методом
- •Порядок выполнения работы
- •Контрольные вопросы
- •Библиографический список
- •Определение момента инерции маховика
- •Описание установки и метода измерений
- •Порядок выполнения работы
- •Контрольные вопросы
- •Библиографический список
- •Определение момента инерции маятника максвелла
- •Описание установки и метода измерений
- •Порядок выполнения работы
- •Контрольные вопросы
- •Библиографический список
- •Изучение законов вращательного движения и определение момента силы трения
- •Описание установки и метода измерений
- •Порядок выполнения работы
- •Контрольные вопросы
- •Библиографический список
- •Проверка основного закона динамики вращательного движения твердого тела
- •Описание установки и метода измерений
- •Порядок выполнения работы
- •Контрольные вопросы
- •Библиографический список
- •Определение моментов инерции твердых тел методом крутильных колебаний
- •Описание установки и метода измерений
- •Порядок выполнения работы.
- •Контрольные вопросы
- •Библиографический список
- •Определение ускорения свободного падения маятником-стержнем
- •Описание установки и метода измерения
- •Порядок выполнения работы
- •Контрольные вопросы
- •Библиографический список.
- •Пружинный маятник
- •Краткая теория
- •Продифференцировав дважды функцию (2) по времени, получим
- •Описание установки и метода измерений
- •Порядок выполнения работы
- •Проверка закона Гука
- •Определение коэффициента упругости
- •Контрольные вопросы
- •Библиографический список
- •Определение ускорения свободного падения оборотным маятником
- •Теоретические сведения
- •Описание установки и метода измерений
- •Порядок выполнения работы
- •Контрольные вопросы
- •Библиографический список
- •Изучение колебаний струны
- •Общие сведения
- •Описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Библиографический список
- •Определение скорости звука в воздухе методом стоячей волны
- •Общие сведения
- •Описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Библиографический список
- •Изучение механических затухающих колебаний
- •Общие сведения
- •Описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Библиографический список
- •Определение отношения теплоемкости газа при постоянном давлении к теплоемкости при постоянном объеме
- •Краткие теоретические сведения.
- •Элементарная работа газа при равновесном расширении:
- •Описание установки и метода Клемана и Дезорма.
- •Контрольные вопросы
- •Библиографический список
- •Определение показателя адиабаты воздуха по скорости распространения звука
- •Общие сведения
- •Изменение давления при деформации:
- •В дифференциальной форме:
- •При адиабатическом процессе объем и давление газа связаны уравнением Пуассона:
- •Описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Библиографический список
- •Определение коэффициента внутреннего трения для воздуха и средней длины свободного пробега молекул газа
- •Краткие теоретические сведения
- •Описание установки.
- •Порядок выполнения работы
- •Контрольные вопросы
- •Библиографический список
- •Определение вязкости жидкости методом стокса
- •Краткие теоретические сведения
- •Описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Библиографический список
- •Измерение теплопроводности газа
- •Краткие теоретические сведения
- •Описание установки
- •Порядок выполнения работы
- •Обработка результатов
- •Контрольные вопросы
- •Библиографический список
- •Определение коэффициента поверхностного натяжения жидкости по методу максимального давления в пузырьке
- •Краткие теоретические сведения
- •Описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Библиографический список
- •Руководство по расчету случайной погрешности
- •Работа с калькулятором
- •Оглавление
Описание установки и метода Клемана и Дезорма.
У становка
состоит из стеклянного баллона Б,
поршневого насоса Н, водяного
манометра М, клапана-крана К рис.1.
Роль клапана-крана на некоторых установках
может выполнять резиновая трубка.
становка
состоит из стеклянного баллона Б,
поршневого насоса Н, водяного
манометра М, клапана-крана К рис.1.
Роль клапана-крана на некоторых установках
может выполнять резиновая трубка.
Е![]() сли
при помощи насоса накачать в баллон
некоторое количество воздуха, то его
давление и температура повысятся.
Вследствие теплообмена с окружающей
средой температура воздуха в баллоне
через некоторое время сравняется с
температурой окружающей среды. Давление
Р1, установившееся в
баллоне, больше атмосферного на величину,
определяемую разностью уровней h1
жидкости в коленах манометра (рис.
1). Р и h измеряются
в мм водяного столба.
сли
при помощи насоса накачать в баллон
некоторое количество воздуха, то его
давление и температура повысятся.
Вследствие теплообмена с окружающей
средой температура воздуха в баллоне
через некоторое время сравняется с
температурой окружающей среды. Давление
Р1, установившееся в
баллоне, больше атмосферного на величину,
определяемую разностью уровней h1
жидкости в коленах манометра (рис.
1). Р и h измеряются
в мм водяного столба.
Е сли
обозначить через m
массу воздуха в баллоне при атмосферном
давлении, то при давлении
сли
обозначить через m
массу воздуха в баллоне при атмосферном
давлении, то при давлении
![]() воздух займет меньший объем, чем объем
сосуда. Обозначим этот объем через
воздух займет меньший объем, чем объем
сосуда. Обозначим этот объем через
![]() .
Тогда состояние воздуха массой m
внутри баллона будет характеризоваться
параметрами
.
Тогда состояние воздуха массой m
внутри баллона будет характеризоваться
параметрами![]() ,
,![]() ,
,
![]() .
.
На рис. 2 данному сoстоянию соответствует точка А.
Если открыть на короткое время кран К,
то воздух в баллоне расширится. Давление
внутри баллона в конце расширения
сравняется с атмосферным (обозначим
его через
![]() ,
объем рассматриваемой массы воздуха
равен объему сосуда
,
объем рассматриваемой массы воздуха
равен объему сосуда
![]() .
Так как процесс быстрого расширения
воздуха можно считать адиабатическим,
то температура газа
.
Так как процесс быстрого расширения
воздуха можно считать адиабатическим,
то температура газа
![]() станет ниже комнатной.
станет ниже комнатной.
Следовательно, в конце адиабатического
расширения (точка Б на рис. 2) параметры
газа будут
![]()
Применяя к этому состоянию уравнение Пуассона, получим:
О![]() хладившийся
при расширении воздух в баллоне через
некоторое время, вследствие теплообмена,
нагреется до комнатной температуры
(процесс нагревания является изохорическим).
Поэтому давление воздуха возрастет до
некоторой величины
хладившийся
при расширении воздух в баллоне через
некоторое время, вследствие теплообмена,
нагреется до комнатной температуры
(процесс нагревания является изохорическим).
Поэтому давление воздуха возрастет до
некоторой величины
![]() .
Это давление будет больше атмосферного
на величину, определяемую разностью
уровней жидкости в коленах манометра
.
Это давление будет больше атмосферного
на величину, определяемую разностью
уровней жидкости в коленах манометра
![]() .
Параметры этого состояния (точка Д на
рис. 2):
.
Параметры этого состояния (точка Д на
рис. 2):
![]() .
,
.
,
![]() .
.
На графике рис. 2 показаны процессы перехода газа из одного состояния в другое. Линия АБ является адиабатой, БД- изохорой, АД-изотермой.
Так как переход газа из состояния А
в состояние Б происходит адиабатически,
то он подчиняется уравнению Пуассона
(![]() ),
которое в данном случае удобно записать
в форме
),
которое в данном случае удобно записать
в форме
 (6)
(6)
Дальнейший переход из состояния Б в состояние Д может быть охарактеризован уравнением Гей-Люссака (изохорический процесс):
![]() (7)
(7)
Исключив из уравнений (6) и (7) температуру
и учтя, что
![]() ,
получим
,
получим
 (8)
(8)
Подставляя в (8) значения давлений Р1
и Р3, выраженные через давление
Р2 и разность столбов жидкости в
манометре (![]()
![]() ),
получим
),
получим

В условиях эксперимента
![]() и
и
![]() значительно
меньше единицы, поэтому можно ограничиться
лишь двумя первыми членами биномов
Ньютона, что дает
значительно
меньше единицы, поэтому можно ограничиться
лишь двумя первыми членами биномов
Ньютона, что дает

Отсюда можно получить расчетную формулу для коэффициента Пуассона:
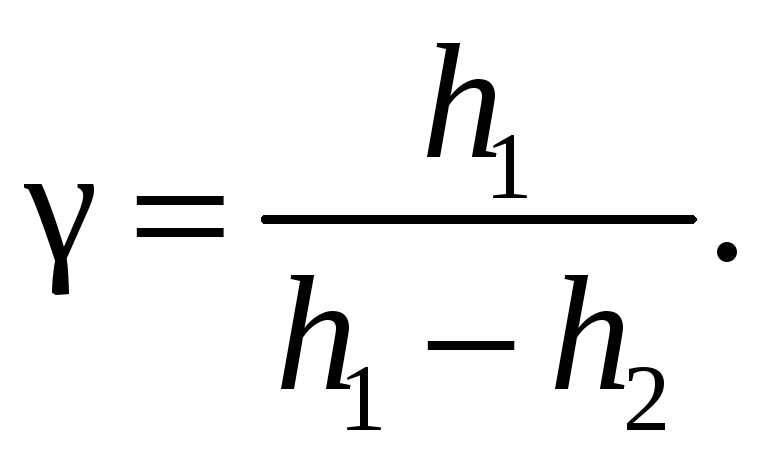 (9)
(9)
Порядок выполнения работы.
1. Проверить, нет ли утечки газа из баллона. Для этого с помощью поршневого насоса медленно нагнетают в баллон воздух. За повышением давления воздуха в баллоне наблюдают по разности уровней в коленах манометра. Так как при нагнетании воздуха температура его несколько повысится, следует подождать 2-3 минуты, пока установится тепловое равновесие с окружающей средой. После этого, если показания манометра не изменяются (нет утечки воздуха), записывают значение h1, соответствующее исходному состоянию (А).
2. Открыть клапан-кран (К), соединяя воздух в баллоне с атмосферой. Как только выровняется давление воздух внутри баллона с атмосферным (прекратится шипение воздуха), клапан-кран быстро закрыть, или при отсутствии клапана-крана пережать резиновую трубку.
Предполагается, что этот процесс соответствует адиабате АВ (рис.2). Давление воздуха в баллоне понизится до атмосферного, а газ охладится. Однако, в результате теплообмена с окружающей средой через 2-3 минуты после закрытия клапана-крана газ изохорически перейдет в состояние Д. Давление воздуха в баллоне возрастет и появится разность уровней h2 в коленах манометра. Указанный эксперимент повторить 5-6 раз. Результаты измерений h1 и h2 записать в табл. 1.
Таблица 1
|
№ п/п |
h1i |
h2i |
g i |
g i -<g> |
(gi -<g>)2 |
|
1 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
4 |
|
|
|
|
|
|
. |
|
|
|
|
|
|
. |
|
|
|
|
|
|
|
|
|
<g> |
S(g i -<g>) |
S(g i -<g>)2 |
|
|
|
|
|
|
|
3. По формуле (9) вычислить g i для каждого опыта.
4. Вычислить абсолютную и относительную погрешность по формуле:

5. Записать конечный результат в виде:
g = <g> ± Dg.
6. Рассчитать g теоретически, считая воздух двухатомным газом. Сравнить экспериментальный результат с теоретическим. Объяснить расхождение результатов.
