
- •Предмет и основные понятия химической кинетики (система; фаза; процессы и их классификация; скорость и факторы, влияющие на скорость гомогенных и гетерогенных реакций).
- •Зависимость скорости химических реакций от концентраций (парциальных давлений) реагирующих веществ. Закон действия масс, константа скорости.
- •3. Влияние температуры на скорость химических реакций: правило Вант-Гоффа, уравнение Аррениуса.
- •Энергия активации, энергетические диаграммы реакций. Влияние катализаторов на скорость реакций.
- •5. Химическое равновесие: кинетическое условие равновесия, факторы, влияющие на его состояние. Смещение равновесия (принцип Ле Шателье).
- •6. Константа химического равновесия (вывод; Кс, Кр, их взаимосвязь).
- •7. Зависимость констант скорости и химического равновесия от температуры. Уравнение изобары химической реакции.
- •8. Предмет, задачи, основные понятия и определения химической термодинамики (системы, параметры, функции).
- •9. Первый закон термодинамики; внутренняя энергия, энтальпия.
- •10. Применение первого закона термодинамики к изохорным и изобарным процессам. Тепловые эффекты химических реакций. Стандартные энтальпии образования веществ.
- •11. Законы термохимии (Гесса, Лавуазье–Лапласа). Расчет энергетических эффектов физико-химических процессов. Уравнение Кирхгофа.
- •12. Второй закон термодинамики. Энтропия (физический смысл; факторы, влияющие на величину энтропии). Изменение энтропии в различных физико-химических процессах.
- •13. Объединенное уравнение первого и второго законов термодинамики. Энергия Гиббса и энергия Гельмгольца.
- •14. Термодинамические критерии (энтальпийный и энтропийный факторы) возможности и направленности физико-химических процессов.
- •15. Термодинамическое условие состояние равновесия. Взаимосвязь свободной энергии Гиббса и константы равновесия. Уравнения изотермы и изобары химической реакции.
- •17. Растворы электролитов. Теория электролитической диссоциации. Кислоты, основания, соли в свете теории электролитической диссоциации.
- •18. Количественные характеристики растворов электролитов: степень и константа диссоциации; классификация электролитов. Степень диссоциации. Сильные и слабые электролиты
- •19. Сильные электролиты: активность ионов, коэффициент активности. Определение концентрации и активности ионов в растворах сильных электролитов.
- •20. Слабые электролиты: смещение равновесия в растворах слабых электролитов; степень и константа диссоциации, закон разбавления Оствальда.
- •21. Ионное произведение воды. Водородный (рН) и гидроксильный (рОн) показатели; их роль в различных физико–химических процессах.
- •22. Реакции обмена и гидролиза в растворах электролитов (ионно-молекулярные уравнения); степень и константа гидролиза.
- •23. Определение рН среды при гидролизе солей: по катиону, по аниону, по катиону и аниону.
- •24. Окислительно-восстановительные реакции: степень окисления; основные окислители и восстановители; способы составления уравнений овр (метод электродного баланса, электронно-ионный метод).
- •25. Электрохимические процессы и системы. Электродный потенциал и механизм его возникновения (двойной электрический слой). Условие протекания электрохимических окислительно-восстановительных реакций.
- •26. Электрод сравнения – водородный электрод. Определение величин стандартных электродных потенциалов. Электрохимический ряд напряжений.
- •27. Электроды 1-го рода (металлические и газовые). Расчет равновесных электродных потенциалов, уравнение Нернста.
- •28. Гальванические элементы: принцип действия, виды, основные характеристики (эдс, а мах, Кр , ∆g).
- •29. Химические и концентрационные гальванические элементы (схемы, уравнения электродных реакций, характеристики).
- •30. Явление поляризации и способы деполяризации в гальванических элементах.
- •31. Элемент Вольта (принцип действия, уравнения электродных реакций, эдс).
- •32. Общие закономерности процессов электролиза; факторы, определяющие характер и скорость электродных реакций.
- •33. Электролиз растворов и расплавов электролитов на инертных и активных электродах.
- •34. Поляризация и перенапряжение при электролизе. Эдс разложения.
- •35. Количественные законы электролиза – законы Фарадея (первый, второй, объединенный). Выход по току.
- •36. Химические источники тока: первичные, периодического действия (аккумуляторы), топливные элементы.
- •37. Применение процессов электролиза в технике (электрометаллургия, гальванотехника, оксидирование, электрорафинирование, хемотроника и др.).
- •38. Коррозия металлов: химическая и электрохимическая (общая характеристика, механизм протекания).
- •39. Электрохимическая коррозия металлов (причины и условия возникновения, механизм).
- •40. Коррозия с водородной и кислородной деполяризацией (условия протекания, способы замедления).
- •41. Электрохимическое и термодинамическое условия протекания коррозии, влияние вторичных продуктов коррозии на ее скорость.
- •42. Химические и электрохимические методы защиты металлов от коррозии (легирование, покрытия, протекторная и катодная защита).
- •43. Основные положения квантовой теории строения атома. Квантовые числа.
- •44. Электронные конфигурации атомов. Принцип Паули, правило Гунда. Принцип Паули: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
- •45. Структура многоэлектронных атомов. Принцип наименьшей энергии, правила Клечковского.
- •46. Общие положения теории химической связи (природа, условия образования, параметры). Ковалентная связь: способы образования, свойства.
- •47. Виды химической связи (ионная, металлическая, водородная) и их основные характеристики.
- •48. Металлы и их общая характеристика: химическая связь и структура, физические свойства, способы получения металлов.
- •49. Общие химические свойства металлов: взаимодействие с элементарными и сложными окислителями.
- •50. Элементарные полупроводники (положение в периодической системе элементов, общая характеристика); кремний и германий (нахождение в природе, способы получения, физические и химические свойства).
7. Зависимость констант скорости и химического равновесия от температуры. Уравнение изобары химической реакции.
Константа равновесия зависит от температуры и природы реагирующих веществ и не зависит от концентраций (парциальных давлений), присутствия катализатора. Введение катализатора в систему не влияет на отношение kпр / kобр, т.е. на значение константы равновесия: одинаково уменьшается энергия активации и увеличивается константа скорости как прямой, так и обратной реакций.
Увеличение или уменьшение константы равновесия при изменении температуры определяется соотношением между энергиями активации прямой и обратной реакций. Разность энергий активации прямой и обратной реакций определяет тепловой эффект процесса Н = Еа. пр – Еа. обр.
Для эндотермической реакции (Δ Н > 0, Q < 0) энергия активации прямой реакции больше энергии активации обратной и с увеличением температуры скорость прямой реакции увеличится больше, чем скорость обратной (следствие из уравнения Аррениуса). Следовательно, увеличивается отношение kпр / kобр, определяя рост численного значения константы равновесия эндотермической реакции при повышении температуры.
Для экзотермической реакции (Δ Н < 0, Q > 0) энергия активации прямой реакции меньше энергии активации обратной и с увеличением температуры скорость обратной реакции увеличится больше, чем скорость прямой (следствие из уравнения Аррениуса). Следовательно, отношение kпр / kобр уменьшается и при повышении температуры уменьшается константа равновесия экзотермической реакции.
Вывод уравнения изобары химической реакции:

Для
расчетов ур-ие изобары логарифмируется
по основанию e и если
 константы, то
константы, то
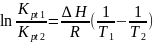 .
.
8. Предмет, задачи, основные понятия и определения химической термодинамики (системы, параметры, функции).
Термодинамика – это наука о превращениях различных видов энергии при взаимодействиях ограниченных теплообменом и работой.
Хим. Термодинамика применяет законы общей термодинамики к физ-хим процессам и фазовым превращениям.
Хим термодинамика позволяет: 1) предсказать условие устойчивости веществ и возможность их взаимодействия; 2) провести расчет тепловых эффектов реакции, величины константы равновесия (глубину протекания процесса); 3)выбрать оптимальный режим процесса; 4) определить пути подавления нежелательных процессов. Термодинамическая система – это совокупность тел (в-в) способных обмениваться друг с другом, с другими системами и окружающей средой энергией и веществом. Термодинамические системы делятся на: 1)открытые(обмениваются с окружающей средой и энергией и веществом); 2)закрытые(обмениваются с окружающей средой только энергией) 3)изолированные (исключен всякий обмен с окружающей средой);
Параметры
состояния систем разделяются на
интенсивные – не зависящие от массы и
числа частиц системы (T,
p и удельные величины),
экстенсивные – пропорциональные массе
и числу частиц системы ( ,теплоемкость,
внутренняя энергия, энтальпия,
энтропия).
Любая система состоит из
материал. частиц, находящихся в непрерывном
движении. Мерой движения является
энергия. В общем случае
,теплоемкость,
внутренняя энергия, энтальпия,
энтропия).
Любая система состоит из
материал. частиц, находящихся в непрерывном
движении. Мерой движения является
энергия. В общем случае
 ;
в термодинамике
;
в термодинамике
 .
Внутренняя энергия (
.
Внутренняя энергия ( это сумма всех видов энергии частиц
составляющих систему. Измерить абсолютное
значение
это сумма всех видов энергии частиц
составляющих систему. Измерить абсолютное
значение
 – невозможно, поэтому определяют
изменение
при переходе из одного состояния в
другое.
– невозможно, поэтому определяют
изменение
при переходе из одного состояния в
другое.
 ,
при этом путь перехода из состояния 1 в
состояние 2 не влияет на величину
,
при этом путь перехода из состояния 1 в
состояние 2 не влияет на величину
 .
есть функция состояния, т.е. зависит
только от начального и конечного
состояния системы. Изменения внутренней
энергии системы может происходить за
счет обмена с другими системами или
окружающей средой в форме теплоты и
работы. Теплота есть неупорядоченная
форма передачи энергии за счет хаотического
столкновения молекул соприкасающихся
тел или веществ. Работа есть мера
переданной энергии путём упорядоченного
перемещения масс под действием каких-либо
сил.
.
есть функция состояния, т.е. зависит
только от начального и конечного
состояния системы. Изменения внутренней
энергии системы может происходить за
счет обмена с другими системами или
окружающей средой в форме теплоты и
работы. Теплота есть неупорядоченная
форма передачи энергии за счет хаотического
столкновения молекул соприкасающихся
тел или веществ. Работа есть мера
переданной энергии путём упорядоченного
перемещения масс под действием каких-либо
сил.
