
- •Предмет и основные понятия химической кинетики (система; фаза; процессы и их классификация; скорость и факторы, влияющие на скорость гомогенных и гетерогенных реакций).
- •Зависимость скорости химических реакций от концентраций (парциальных давлений) реагирующих веществ. Закон действия масс, константа скорости.
- •3. Влияние температуры на скорость химических реакций: правило Вант-Гоффа, уравнение Аррениуса.
- •Энергия активации, энергетические диаграммы реакций. Влияние катализаторов на скорость реакций.
- •5. Химическое равновесие: кинетическое условие равновесия, факторы, влияющие на его состояние. Смещение равновесия (принцип Ле Шателье).
- •6. Константа химического равновесия (вывод; Кс, Кр, их взаимосвязь).
- •7. Зависимость констант скорости и химического равновесия от температуры. Уравнение изобары химической реакции.
- •8. Предмет, задачи, основные понятия и определения химической термодинамики (системы, параметры, функции).
- •9. Первый закон термодинамики; внутренняя энергия, энтальпия.
- •10. Применение первого закона термодинамики к изохорным и изобарным процессам. Тепловые эффекты химических реакций. Стандартные энтальпии образования веществ.
- •11. Законы термохимии (Гесса, Лавуазье–Лапласа). Расчет энергетических эффектов физико-химических процессов. Уравнение Кирхгофа.
- •12. Второй закон термодинамики. Энтропия (физический смысл; факторы, влияющие на величину энтропии). Изменение энтропии в различных физико-химических процессах.
- •13. Объединенное уравнение первого и второго законов термодинамики. Энергия Гиббса и энергия Гельмгольца.
- •14. Термодинамические критерии (энтальпийный и энтропийный факторы) возможности и направленности физико-химических процессов.
- •15. Термодинамическое условие состояние равновесия. Взаимосвязь свободной энергии Гиббса и константы равновесия. Уравнения изотермы и изобары химической реакции.
- •17. Растворы электролитов. Теория электролитической диссоциации. Кислоты, основания, соли в свете теории электролитической диссоциации.
- •18. Количественные характеристики растворов электролитов: степень и константа диссоциации; классификация электролитов. Степень диссоциации. Сильные и слабые электролиты
- •19. Сильные электролиты: активность ионов, коэффициент активности. Определение концентрации и активности ионов в растворах сильных электролитов.
- •20. Слабые электролиты: смещение равновесия в растворах слабых электролитов; степень и константа диссоциации, закон разбавления Оствальда.
- •21. Ионное произведение воды. Водородный (рН) и гидроксильный (рОн) показатели; их роль в различных физико–химических процессах.
- •22. Реакции обмена и гидролиза в растворах электролитов (ионно-молекулярные уравнения); степень и константа гидролиза.
- •23. Определение рН среды при гидролизе солей: по катиону, по аниону, по катиону и аниону.
- •24. Окислительно-восстановительные реакции: степень окисления; основные окислители и восстановители; способы составления уравнений овр (метод электродного баланса, электронно-ионный метод).
- •25. Электрохимические процессы и системы. Электродный потенциал и механизм его возникновения (двойной электрический слой). Условие протекания электрохимических окислительно-восстановительных реакций.
- •26. Электрод сравнения – водородный электрод. Определение величин стандартных электродных потенциалов. Электрохимический ряд напряжений.
- •27. Электроды 1-го рода (металлические и газовые). Расчет равновесных электродных потенциалов, уравнение Нернста.
- •28. Гальванические элементы: принцип действия, виды, основные характеристики (эдс, а мах, Кр , ∆g).
- •29. Химические и концентрационные гальванические элементы (схемы, уравнения электродных реакций, характеристики).
- •30. Явление поляризации и способы деполяризации в гальванических элементах.
- •31. Элемент Вольта (принцип действия, уравнения электродных реакций, эдс).
- •32. Общие закономерности процессов электролиза; факторы, определяющие характер и скорость электродных реакций.
- •33. Электролиз растворов и расплавов электролитов на инертных и активных электродах.
- •34. Поляризация и перенапряжение при электролизе. Эдс разложения.
- •35. Количественные законы электролиза – законы Фарадея (первый, второй, объединенный). Выход по току.
- •36. Химические источники тока: первичные, периодического действия (аккумуляторы), топливные элементы.
- •37. Применение процессов электролиза в технике (электрометаллургия, гальванотехника, оксидирование, электрорафинирование, хемотроника и др.).
- •38. Коррозия металлов: химическая и электрохимическая (общая характеристика, механизм протекания).
- •39. Электрохимическая коррозия металлов (причины и условия возникновения, механизм).
- •40. Коррозия с водородной и кислородной деполяризацией (условия протекания, способы замедления).
- •41. Электрохимическое и термодинамическое условия протекания коррозии, влияние вторичных продуктов коррозии на ее скорость.
- •42. Химические и электрохимические методы защиты металлов от коррозии (легирование, покрытия, протекторная и катодная защита).
- •43. Основные положения квантовой теории строения атома. Квантовые числа.
- •44. Электронные конфигурации атомов. Принцип Паули, правило Гунда. Принцип Паули: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
- •45. Структура многоэлектронных атомов. Принцип наименьшей энергии, правила Клечковского.
- •46. Общие положения теории химической связи (природа, условия образования, параметры). Ковалентная связь: способы образования, свойства.
- •47. Виды химической связи (ионная, металлическая, водородная) и их основные характеристики.
- •48. Металлы и их общая характеристика: химическая связь и структура, физические свойства, способы получения металлов.
- •49. Общие химические свойства металлов: взаимодействие с элементарными и сложными окислителями.
- •50. Элементарные полупроводники (положение в периодической системе элементов, общая характеристика); кремний и германий (нахождение в природе, способы получения, физические и химические свойства).
35. Количественные законы электролиза – законы Фарадея (первый, второй, объединенный). Выход по току.
Существует три закона Фарадея. Они устанавливают связь между количеством прошедшего через электролит электричества и массами или объемами (для газов) выделившихся на электродах или преобразованных в электролите веществ.
Первый закон:
Массы (объемы) веществ, выделившихся на электродах или превращенных в электролите, прямопорциальны кол-ву электричества, прошедшего через раствор или расплав электролита.
M=KQ=KIt V=KQ=KIt.
Второй закон:
При пропускании одинакового кол-ва электричества через растворы или расплавы различных электролитов массы (объемы) выделившихся на электродах или преобразованных в электролите в-в пропорциональны их эквивалентным массам или эквивалентным объемам.
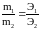 ;
;
;
;
Третий закон:
Объединенный первый и второй законы Фарадея.
 ;
;

Следует заметить, что количества веществ, полученных практически, всегда меньше рассчитанных, что численно характеризуется величиной выхода по току (ВТ).
;
С учетом выхода по току уравнения примут вид:
 ;
;

36. Химические источники тока: первичные, периодического действия (аккумуляторы), топливные элементы.
Химические источники тока (ХИТ) предназначены для преобразования химической энергии в электрическую.
Первый химический источник тока был изобретён итальянским учёным Алессандро Вольта в 1800 году. Это был элемент Вольта — сосуд с солёной водой с опущенными в него цинковой и медной пластинками, соединенными проволокой. Затем учёный собрал батарею из этих элементов, которая впоследствии была названа Вольтовым столбом.
По возможности или невозможности повторного использования химические источники тока делятся на:
гальванические элементы (первичные ХИТ), которые из-за необратимости протекающих в них реакций, невозможно перезарядить;
электрические аккумуляторы (вторичные ХИТ) — перезаряжаемые гальванические элементы, которые с помощью внешнего источника тока (зарядного устройства) можно перезарядить;
топливные элементы (электрохимические генераторы) — устройства, подобные гальваническому элементу, но отличающееся от него тем, что вещества для электрохимической реакции подаются в него извне, а продукты реакций удаляются из него, что позволяет ему функционировать непрерывно.
Следует заметить, что деление элементов на гальванические и аккумуляторы до некоторой степени условное, так как некоторые гальванические элементы, например щелочные батарейки, поддаются подзарядке, но эффективность этого процесса крайне низка.
37. Применение процессов электролиза в технике (электрометаллургия, гальванотехника, оксидирование, электрорафинирование, хемотроника и др.).
Электролиз нашел широкое применение в технике, например в металлургии, химической промышленности и т. д.
Электрометаллургия — Методы получения металлов, основанные на электролизе, т. е. выделении металлов из растворов или расплавов их соединений при пропускании через них постоянного электрического тока. Этот метод применяют главным образом для получения очень активных металлов – щелочных, щелочноземельных и алюминия, а также производства легированных сталей.
Гальванотехника — отдел прикладной электрохимии, который включает гальваностегию и гальванопластику. Гальванопластика — получение сравнительно толстого слоя металлических осадков на поверхности какого-либо предмета.
Целью гальванопластики является получение точной металлической копии предмета. При гальванопластике осадки получаются массивными, прочными, легко отделяющимися от покрываемой поверхности. Основное применение в гальванопластике имеет медь.
Гальваностегия — электролитическое осаждение тонкого слоя металла на поверхности какого-либо металлического предмета для защиты его от коррозии, повышения износоустойчивости, предохранения от цементации, в декоративных целях и т. д.
Оксидирование — создание оксидной плёнки на поверхности изделия или заготовки в результате окислительно-восстановительной реакции. Оксидирование преимущественно используют для получения защитных и декоративных покрытий, а также для формирования диэлектрических слоёв. Различают термические, химические, электрохимические (или анодные) и плазменные методы оксидирования.
Электрорафинирование – это процесс очистки металлов от примесей при помощи электролиза.
Хемотроника - научно-техническое направление, занимающееся вопросами исследования, разработки и применения приборов и устройств автоматики, измерительной и вычислительной техники, действие которых основано на электрохимических процессах и явлениях, имеющих место на границе электрод — электролит при пропускании электрического тока.
