
- •Предмет и основные понятия химической кинетики (система; фаза; процессы и их классификация; скорость и факторы, влияющие на скорость гомогенных и гетерогенных реакций).
- •Зависимость скорости химических реакций от концентраций (парциальных давлений) реагирующих веществ. Закон действия масс, константа скорости.
- •3. Влияние температуры на скорость химических реакций: правило Вант-Гоффа, уравнение Аррениуса.
- •Энергия активации, энергетические диаграммы реакций. Влияние катализаторов на скорость реакций.
- •5. Химическое равновесие: кинетическое условие равновесия, факторы, влияющие на его состояние. Смещение равновесия (принцип Ле Шателье).
- •6. Константа химического равновесия (вывод; Кс, Кр, их взаимосвязь).
- •7. Зависимость констант скорости и химического равновесия от температуры. Уравнение изобары химической реакции.
- •8. Предмет, задачи, основные понятия и определения химической термодинамики (системы, параметры, функции).
- •9. Первый закон термодинамики; внутренняя энергия, энтальпия.
- •10. Применение первого закона термодинамики к изохорным и изобарным процессам. Тепловые эффекты химических реакций. Стандартные энтальпии образования веществ.
- •11. Законы термохимии (Гесса, Лавуазье–Лапласа). Расчет энергетических эффектов физико-химических процессов. Уравнение Кирхгофа.
- •12. Второй закон термодинамики. Энтропия (физический смысл; факторы, влияющие на величину энтропии). Изменение энтропии в различных физико-химических процессах.
- •13. Объединенное уравнение первого и второго законов термодинамики. Энергия Гиббса и энергия Гельмгольца.
- •14. Термодинамические критерии (энтальпийный и энтропийный факторы) возможности и направленности физико-химических процессов.
- •15. Термодинамическое условие состояние равновесия. Взаимосвязь свободной энергии Гиббса и константы равновесия. Уравнения изотермы и изобары химической реакции.
- •17. Растворы электролитов. Теория электролитической диссоциации. Кислоты, основания, соли в свете теории электролитической диссоциации.
- •18. Количественные характеристики растворов электролитов: степень и константа диссоциации; классификация электролитов. Степень диссоциации. Сильные и слабые электролиты
- •19. Сильные электролиты: активность ионов, коэффициент активности. Определение концентрации и активности ионов в растворах сильных электролитов.
- •20. Слабые электролиты: смещение равновесия в растворах слабых электролитов; степень и константа диссоциации, закон разбавления Оствальда.
- •21. Ионное произведение воды. Водородный (рН) и гидроксильный (рОн) показатели; их роль в различных физико–химических процессах.
- •22. Реакции обмена и гидролиза в растворах электролитов (ионно-молекулярные уравнения); степень и константа гидролиза.
- •23. Определение рН среды при гидролизе солей: по катиону, по аниону, по катиону и аниону.
- •24. Окислительно-восстановительные реакции: степень окисления; основные окислители и восстановители; способы составления уравнений овр (метод электродного баланса, электронно-ионный метод).
- •25. Электрохимические процессы и системы. Электродный потенциал и механизм его возникновения (двойной электрический слой). Условие протекания электрохимических окислительно-восстановительных реакций.
- •26. Электрод сравнения – водородный электрод. Определение величин стандартных электродных потенциалов. Электрохимический ряд напряжений.
- •27. Электроды 1-го рода (металлические и газовые). Расчет равновесных электродных потенциалов, уравнение Нернста.
- •28. Гальванические элементы: принцип действия, виды, основные характеристики (эдс, а мах, Кр , ∆g).
- •29. Химические и концентрационные гальванические элементы (схемы, уравнения электродных реакций, характеристики).
- •30. Явление поляризации и способы деполяризации в гальванических элементах.
- •31. Элемент Вольта (принцип действия, уравнения электродных реакций, эдс).
- •32. Общие закономерности процессов электролиза; факторы, определяющие характер и скорость электродных реакций.
- •33. Электролиз растворов и расплавов электролитов на инертных и активных электродах.
- •34. Поляризация и перенапряжение при электролизе. Эдс разложения.
- •35. Количественные законы электролиза – законы Фарадея (первый, второй, объединенный). Выход по току.
- •36. Химические источники тока: первичные, периодического действия (аккумуляторы), топливные элементы.
- •37. Применение процессов электролиза в технике (электрометаллургия, гальванотехника, оксидирование, электрорафинирование, хемотроника и др.).
- •38. Коррозия металлов: химическая и электрохимическая (общая характеристика, механизм протекания).
- •39. Электрохимическая коррозия металлов (причины и условия возникновения, механизм).
- •40. Коррозия с водородной и кислородной деполяризацией (условия протекания, способы замедления).
- •41. Электрохимическое и термодинамическое условия протекания коррозии, влияние вторичных продуктов коррозии на ее скорость.
- •42. Химические и электрохимические методы защиты металлов от коррозии (легирование, покрытия, протекторная и катодная защита).
- •43. Основные положения квантовой теории строения атома. Квантовые числа.
- •44. Электронные конфигурации атомов. Принцип Паули, правило Гунда. Принцип Паули: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
- •45. Структура многоэлектронных атомов. Принцип наименьшей энергии, правила Клечковского.
- •46. Общие положения теории химической связи (природа, условия образования, параметры). Ковалентная связь: способы образования, свойства.
- •47. Виды химической связи (ионная, металлическая, водородная) и их основные характеристики.
- •48. Металлы и их общая характеристика: химическая связь и структура, физические свойства, способы получения металлов.
- •49. Общие химические свойства металлов: взаимодействие с элементарными и сложными окислителями.
- •50. Элементарные полупроводники (положение в периодической системе элементов, общая характеристика); кремний и германий (нахождение в природе, способы получения, физические и химические свойства).
13. Объединенное уравнение первого и второго законов термодинамики. Энергия Гиббса и энергия Гельмгольца.
Направление,
в котором самопроизвольно протекает
физико-химический процесс, определяется
совместным действием двух противоположных
факторов: стремлением системы к переходу
в состояние, характеризующееся минимальной
внутренней энергией и энтальпией;
стремлением системы к увеличению
беспорядка. Функцией системы, учитывающей
действие двух названных факторов
является изобарно-изотермический
потенциал (свободная энергия Гиббса) и
изохорно-изотермический потенциал
(свободная энергия Гельмгольца).
Свободная
энергия Гиббса характеризует процессы,
протекающие при P,T
– const.
Запишем выражение
объединяющее первый и второй законы
термодинамики:
1) для изохорных
процессов V=const
(I)
 (II)
(II)
 ;
;
 .
F
– свободная энергия Гельмгольца.
.
F
– свободная энергия Гельмгольца.
 .
2)
для изобарных процессов p=const
(I)
.
2)
для изобарных процессов p=const
(I)
 (II)
;
(II)
;
 G
– свободная энергия Гиббса
G
– свободная энергия Гиббса
 .
Т.к.
максимально полезная работа совершается
системой только в ходе самопроизвольного
процесса, то условиями их самопроизвольного
протекания являются выполнения
неравенства:
V=const,
.
Т.к.
максимально полезная работа совершается
системой только в ходе самопроизвольного
процесса, то условиями их самопроизвольного
протекания являются выполнения
неравенства:
V=const,
 (4)
Чем меньше величины
(4)
Чем меньше величины
 и
и
 ,
тем более реакционноспособна система,
тем глубже протекает процесс в прямом
направлении. Если
,
тем более реакционноспособна система,
тем глубже протекает процесс в прямом
направлении. Если
 или
или
 процесс не возможен в прямом, но возможен
в обратном направлении. Неравенства
(3) и (4) определяют принципиальную
термодинамическую вероятность протекания
процессов.
процесс не возможен в прямом, но возможен
в обратном направлении. Неравенства
(3) и (4) определяют принципиальную
термодинамическую вероятность протекания
процессов.
14. Термодинамические критерии (энтальпийный и энтропийный факторы) возможности и направленности физико-химических процессов.
Возможность
и направление самопроизвольных процессов
определяется действием двух противоположных
факторов:
Энтальпийный фактор.
Стремление системы к более устойчивому
(упорядоченному) состоянию с min
внутренней энергией (при V
= const) или min
энтальпией (при p =
const);
Энтропийный фактор.
Стремление системы к наиболее вероятному
состоянию с большим беспорядком в
расположении частиц.
Для определения
практической осуществимости процесса
необходимо учитывать кинетические
закономерности. Характер изменения
 (энтальпия и энтропия) позволяет
определить температурный режим процесс
в закрытых системах при p
= const.
1)
(энтальпия и энтропия) позволяет
определить температурный режим процесс
в закрытых системах при p
= const.
1)
 .
Неравенство
.
Неравенство
 не выполняется при любых T,
процесс ТД-ски невозможен.
2)
не выполняется при любых T,
процесс ТД-ски невозможен.
2)
 Неравенство
выполняется при любых значениях Т,
процесс ТД-ски возможен.
3)
Неравенство
выполняется при любых значениях Т,
процесс ТД-ски возможен.
3)
 Неравенство
Неравенство
 Благоприятным является низкотемпературный
режим процесса.
4)
Благоприятным является низкотемпературный
режим процесса.
4)
 .
Неравенство
.
Неравенство
 выполняется, если
выполняется, если

 .
Благоприятным является высокотемпературный
режим процесса.
.
Благоприятным является высокотемпературный
режим процесса.
15. Термодинамическое условие состояние равновесия. Взаимосвязь свободной энергии Гиббса и константы равновесия. Уравнения изотермы и изобары химической реакции.
Термодинамическим
условием наступления равновесия является
выполнение равенств
 ;
В данное состояние система приходит в
результате самопроизвольного процесса.
Состояние сохраняется при неизменных
условиях его наступления.
;
В данное состояние система приходит в
результате самопроизвольного процесса.
Состояние сохраняется при неизменных
условиях его наступления.
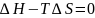 ;
;
 Зависимостью
Зависимостью
 и
и
 можно пренебречь в незначительном
интервале Т
можно пренебречь в незначительном
интервале Т
 .
Связь
между
и
.
Связь
между
и
 возражает уравнение изотермы х.р.
возражает уравнение изотермы х.р.
 (*) ;
Выполняется для реакции с участием
газообразных веществ. Для конденсированных
систем
(*) ;
Выполняется для реакции с участием
газообразных веществ. Для конденсированных
систем
 ; Для реакций протекающих в разбавленных
растворах уравнение (*) можно представить:
.
; Для реакций протекающих в разбавленных
растворах уравнение (*) можно представить:
.
 .
Зависимость .
.
Зависимость .
 от Т выражается уравнением изобары х.р.
от Т выражается уравнением изобары х.р.
 (**) ; Для расчетов уравнение используется
в виде
(**) ; Для расчетов уравнение используется
в виде
 .
(см. тему кинетика)
Уравнение получено
в результате интегрирования уравнения
(**) в интервале от
.
(см. тему кинетика)
Уравнение получено
в результате интегрирования уравнения
(**) в интервале от
 при допущении что
при допущении что
 .
.
16. Общая характеристика растворов. Способы выражения концентрации растворов: процентная концентрация (массовая доля), молярность, нормальность (химические эквиваленты веществ). Общая характеристика растворов электролитов. Электролиты – вещества, которые в растворах и расплавах полностью или частично состоят из ионов и проводят электрический ток. К электролитам относятся водные растворы кислот, оснований и солей, а также расплавы многих солей, оснований, оксидов, гидридов s-металлов.
Электропроводность электролитов обусловлена направленным движением ионов в электрическом поле. Растворы (расплавы) электролитов являются ионными проводниками, или проводниками второго рода. (Проводниками первого рода называют проводники с электронным типом проводимости).
Электролитическая диссоциация – процесс распада молекул электролита на ионы. В растворах диссоциация происходит под действием молекул растворителя.
Электролитической диссоциации подвергаются ионные соединения и молекулярные соединения с полярной ковалентной связью в полярных растворителях, среди которых важнейшим является вода. При электролитической диссоциации в воде ионы гидратированы, т.е. окружены оболочкой из молекул воды, свободные ионы в водных растворах отсутствуют. Уравнения электролитической диссоциации обычно записываются в упрощенной форме без указания гидратной оболочки.
Электролиты при
растворении в воде распадаются
(диссоциируют) на ионы: положительно
заряженные –
катионы (Na+,
Al3+,
Cu2+)
и отрицательно заряженные –
анионы ( ,
,
 ,
,
 ).
При этом раствор остается в целом
электронейтральным: алгебраическая
сумма зарядов ионов равняется нулю.
).
При этом раствор остается в целом
электронейтральным: алгебраическая
сумма зарядов ионов равняется нулю.
С точки зрения
теории электролитической диссоциации
кислотами
называются
вещества, которые диссоциируют в воде
на ионы водорода  ,
основаниями –
вещества, диссоциирующие на гидроксид-ионы
,
основаниями –
вещества, диссоциирующие на гидроксид-ионы
 ,
солями – соединения, образующие при
диссоциации катионы металлов и анионы
кислотных остатков.
,
солями – соединения, образующие при
диссоциации катионы металлов и анионы
кислотных остатков.
Способы выражения концентрации растворов
Важной характеристикой растворов электролитов является их концентрация – содержание растворенного вещества в определенном объеме (массе) раствора или растворителя. Наиболее часто используют следующие способы выражения концентрации растворов:
а) массовая доля (), выраженная в долях от 0 до 1 – отношение массы растворенного вещества (m', г) к массе раствора (m, г):
|
|
Массовая доля растворенного вещества, выраженная в процентах (процентная концентрация) – масса растворенного вещества в 100 г раствора.
Например: 15 %-ный водный раствор хлорида натрия состоит из 15 г NaCl и 85 г H2O;
б) молярная концентрация, или молярность (СМ или М), – число молей растворенного вещества в 1 л раствора:
|
|
где
 –
количество вещества, моль; М – мольная
масса растворенного вещества, г/моль;
V – объем раствора, л.
–
количество вещества, моль; М – мольная
масса растворенного вещества, г/моль;
V – объем раствора, л.
Например:
2 М раствор H2SO4
содержит в 1 л раствора 2 моля Н2SO4,
или 2 98 = 196 г
( = 98 г/моль);
= 98 г/моль);
в) эквивалентная концентрация, или нормальность (Сн или н) – число эквивалентов растворенного вещества в 1 л раствора:
|
|
где Э – эквивалентная масса растворенного вещества, г/моль; nЭ – число моль эквивалентов.
Примечание. Эквивалент элемента (Э) – такое его количество, которое соединяется с 1 молем атомов водорода или ½ моля атомов кислорода. Масса одного эквивалента, выраженная в граммах, называется эквивалентной массой. Эквивалент выражается в молях, эквивалентная масса – в граммах на моль.
Эквивалент водорода равен 1 молю его атомов, а эквивалентная масса равна 1 г/моль.
Эквивалент кислорода равен ½ моля его атомов, а эквивалентная масса равна 8 г/моль.
Эквивалент и эквивалентную массу простого вещества можно рассчитать по формуле
|
|
где М – мольная масса атомов, г/моль; В – валентность.
Например: ЭСа = 40/2 = 20 г/моль, или ½ моль его атомов.
Эквивалентные массы сложных веществ (кислот, оснований, солей) определяются из соотношений:
ЭКИСЛОТЫ
=
|
|
где
МКИСЛОТЫ, МОСНОВАНИЯ, МСОЛИ –
мольные массы соответственно кислоты,
основания, соли, г/моль;
 ,
,
 –
число ионов водорода (гидроксильных
групп), вступивших в реакцию; ВМе –
валентность металла; nМе –
число атомов металла в молекуле соли.
–
число ионов водорода (гидроксильных
групп), вступивших в реакцию; ВМе –
валентность металла; nМе –
число атомов металла в молекуле соли.
Например: 2 н раствор H2SO4 содержит в 1 л раствора 2 Э Н2SO4, или 2 (98/2) = 98 г (98/2 – эквивалентная масса Н2SO4).



 ,
,
 ;
ЭОСНОВАНИЯ =
;
ЭОСНОВАНИЯ = ;
ЭСОЛИ =
;
ЭСОЛИ =
 ,
,