
- •Предмет и основные понятия химической кинетики (система; фаза; процессы и их классификация; скорость и факторы, влияющие на скорость гомогенных и гетерогенных реакций).
- •Зависимость скорости химических реакций от концентраций (парциальных давлений) реагирующих веществ. Закон действия масс, константа скорости.
- •3. Влияние температуры на скорость химических реакций: правило Вант-Гоффа, уравнение Аррениуса.
- •Энергия активации, энергетические диаграммы реакций. Влияние катализаторов на скорость реакций.
- •5. Химическое равновесие: кинетическое условие равновесия, факторы, влияющие на его состояние. Смещение равновесия (принцип Ле Шателье).
- •6. Константа химического равновесия (вывод; Кс, Кр, их взаимосвязь).
- •7. Зависимость констант скорости и химического равновесия от температуры. Уравнение изобары химической реакции.
- •8. Предмет, задачи, основные понятия и определения химической термодинамики (системы, параметры, функции).
- •9. Первый закон термодинамики; внутренняя энергия, энтальпия.
- •10. Применение первого закона термодинамики к изохорным и изобарным процессам. Тепловые эффекты химических реакций. Стандартные энтальпии образования веществ.
- •11. Законы термохимии (Гесса, Лавуазье–Лапласа). Расчет энергетических эффектов физико-химических процессов. Уравнение Кирхгофа.
- •12. Второй закон термодинамики. Энтропия (физический смысл; факторы, влияющие на величину энтропии). Изменение энтропии в различных физико-химических процессах.
- •13. Объединенное уравнение первого и второго законов термодинамики. Энергия Гиббса и энергия Гельмгольца.
- •14. Термодинамические критерии (энтальпийный и энтропийный факторы) возможности и направленности физико-химических процессов.
- •15. Термодинамическое условие состояние равновесия. Взаимосвязь свободной энергии Гиббса и константы равновесия. Уравнения изотермы и изобары химической реакции.
- •17. Растворы электролитов. Теория электролитической диссоциации. Кислоты, основания, соли в свете теории электролитической диссоциации.
- •18. Количественные характеристики растворов электролитов: степень и константа диссоциации; классификация электролитов. Степень диссоциации. Сильные и слабые электролиты
- •19. Сильные электролиты: активность ионов, коэффициент активности. Определение концентрации и активности ионов в растворах сильных электролитов.
- •20. Слабые электролиты: смещение равновесия в растворах слабых электролитов; степень и константа диссоциации, закон разбавления Оствальда.
- •21. Ионное произведение воды. Водородный (рН) и гидроксильный (рОн) показатели; их роль в различных физико–химических процессах.
- •22. Реакции обмена и гидролиза в растворах электролитов (ионно-молекулярные уравнения); степень и константа гидролиза.
- •23. Определение рН среды при гидролизе солей: по катиону, по аниону, по катиону и аниону.
- •24. Окислительно-восстановительные реакции: степень окисления; основные окислители и восстановители; способы составления уравнений овр (метод электродного баланса, электронно-ионный метод).
- •25. Электрохимические процессы и системы. Электродный потенциал и механизм его возникновения (двойной электрический слой). Условие протекания электрохимических окислительно-восстановительных реакций.
- •26. Электрод сравнения – водородный электрод. Определение величин стандартных электродных потенциалов. Электрохимический ряд напряжений.
- •27. Электроды 1-го рода (металлические и газовые). Расчет равновесных электродных потенциалов, уравнение Нернста.
- •28. Гальванические элементы: принцип действия, виды, основные характеристики (эдс, а мах, Кр , ∆g).
- •29. Химические и концентрационные гальванические элементы (схемы, уравнения электродных реакций, характеристики).
- •30. Явление поляризации и способы деполяризации в гальванических элементах.
- •31. Элемент Вольта (принцип действия, уравнения электродных реакций, эдс).
- •32. Общие закономерности процессов электролиза; факторы, определяющие характер и скорость электродных реакций.
- •33. Электролиз растворов и расплавов электролитов на инертных и активных электродах.
- •34. Поляризация и перенапряжение при электролизе. Эдс разложения.
- •35. Количественные законы электролиза – законы Фарадея (первый, второй, объединенный). Выход по току.
- •36. Химические источники тока: первичные, периодического действия (аккумуляторы), топливные элементы.
- •37. Применение процессов электролиза в технике (электрометаллургия, гальванотехника, оксидирование, электрорафинирование, хемотроника и др.).
- •38. Коррозия металлов: химическая и электрохимическая (общая характеристика, механизм протекания).
- •39. Электрохимическая коррозия металлов (причины и условия возникновения, механизм).
- •40. Коррозия с водородной и кислородной деполяризацией (условия протекания, способы замедления).
- •41. Электрохимическое и термодинамическое условия протекания коррозии, влияние вторичных продуктов коррозии на ее скорость.
- •42. Химические и электрохимические методы защиты металлов от коррозии (легирование, покрытия, протекторная и катодная защита).
- •43. Основные положения квантовой теории строения атома. Квантовые числа.
- •44. Электронные конфигурации атомов. Принцип Паули, правило Гунда. Принцип Паули: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
- •45. Структура многоэлектронных атомов. Принцип наименьшей энергии, правила Клечковского.
- •46. Общие положения теории химической связи (природа, условия образования, параметры). Ковалентная связь: способы образования, свойства.
- •47. Виды химической связи (ионная, металлическая, водородная) и их основные характеристики.
- •48. Металлы и их общая характеристика: химическая связь и структура, физические свойства, способы получения металлов.
- •49. Общие химические свойства металлов: взаимодействие с элементарными и сложными окислителями.
- •50. Элементарные полупроводники (положение в периодической системе элементов, общая характеристика); кремний и германий (нахождение в природе, способы получения, физические и химические свойства).
24. Окислительно-восстановительные реакции: степень окисления; основные окислители и восстановители; способы составления уравнений овр (метод электродного баланса, электронно-ионный метод).
Химические реакции, сопровождающиеся изменением степеней окисления атомов одного или нескольких элементов, входящих в состав реагирующих веществ, называются окислительно-восстановительными.
Под степенью окисления атома в молекуле понимают его заряд, вызванный смещением валентных электронов к более электроотрицательному атому, или заряд иона элемента, вычисленный исходя из предположения, что молекула состоит только из ионов.
Метод электронного баланса
Метод электронного баланса заключается в определении степеней
окисления элементов, подвергающихся окислению и восстановлению,
составлении электронных уравнении с последующим сведением элек-тронного баланса. Например, в реакции
КСlO3 —> КСl + 02
степени окисления изменяются у хлора и кислорода. Восстановление
хлора связано с присоединением им электронов, отданных кислородом.
Этот процесс перераспределения электронов может быть выражен элек-
тронными уравнениями

Электронно-ионный метод
При составлении уравнений ОВР электронно-ионным методом необ-
ходимо придерживаться следующего порядка:
•составить частные уравнения процесса окисления и процесса вос-
становления. При этом вещества записывают в той форме, в которой
они существуют в растворе: сильные электролиты— в виде ионов,
слабые — в виде молекул;
•осуществить материальный баланс атомов с участием ионов среды
(Н+ — в кислой, ОН- — в щелочной) или молекул Н2О, а затем элек-
тронный баланс;
•подобрать коэффициенты в уравнениях так, чтобы число электро-
нов, отданных восстановлением, было равно числу электронов, при-
нимаемых окислителем;
•сложить частные уравнения с учетом подобранных коэффициентов;
•исходя из полученного ионного уравнения составить полное молеку-
лярное уравнение.
25. Электрохимические процессы и системы. Электродный потенциал и механизм его возникновения (двойной электрический слой). Условие протекания электрохимических окислительно-восстановительных реакций.
Все металлы характеризуются свойством в большей или в меньшей степени растворяться в воде. Под действием полярных молекул (диполей) воды ионы поверхностного слоя металла отрываются и в гидратированном состоянии переходят в жидкость. При этом пластина металла заряжается отрицательно (из-за появления в ней избыточных электронов), а слой электролита у ее поверхности – положительно (гидратированные катионы металла). В результате электростатического притяжения противоположных зарядов на границе металл – раствор возникает двойной электрический слой и разность потенциалов в нем. С увеличением концентрации катионов у поверхности металла становится вероятным обратный процесс – восстановление ионов металла. Когда скорости указанных процессов сравняются, в системе устанавливается равновесие
Состояние равновесия зависит от активности металла, концентрации его ионов в растворе и численно характеризуется константой равновесия, которая для данной гетерогенной системы при P = const равна
Для
активных металлов (Zn, Fe, Cr и др.) равновесие
смещено вправо (КР>1).
Например, Zn
Для
малоактивных металлов (Cu, Ag, Hg и др.)
равновесная концентрация ионов металла
в растворе очень мала и равновесие
(3.1) смещается влево (КР<1).
Например, Cu условием самопроизвольного протекания окислительно-восстановительных реакций в водных растворах электролитов является неравенство φ (ок-ля) > φ(восст-ля) |

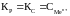 .
.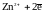 (
( )..
При погружении их в водный раствор
собственной соли для достижения
равновесной концентрации ионы металла
будут переходить в раствор и поверхность
металла зарядится отрицательно, а
раствор электролита – положительно.
)..
При погружении их в водный раствор
собственной соли для достижения
равновесной концентрации ионы металла
будут переходить в раствор и поверхность
металла зарядится отрицательно, а
раствор электролита – положительно.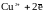
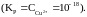 При погружении их в водный раствор
собственной соли для достижения
равновесной концентрации ионы металла
из раствора будут переходить на
поверхность металла и она зарядится
положительно, а раствор электролита
– отрицательно. Потенциал,
возникающий на металлическом электроде,
находящемся в равновесии с собственными
ионами в растворе электролита,
называется электродным потенциалом
(φ, В).
При погружении их в водный раствор
собственной соли для достижения
равновесной концентрации ионы металла
из раствора будут переходить на
поверхность металла и она зарядится
положительно, а раствор электролита
– отрицательно. Потенциал,
возникающий на металлическом электроде,
находящемся в равновесии с собственными
ионами в растворе электролита,
называется электродным потенциалом
(φ, В).