
- •Предмет и основные понятия химической кинетики (система; фаза; процессы и их классификация; скорость и факторы, влияющие на скорость гомогенных и гетерогенных реакций).
- •Зависимость скорости химических реакций от концентраций (парциальных давлений) реагирующих веществ. Закон действия масс, константа скорости.
- •3. Влияние температуры на скорость химических реакций: правило Вант-Гоффа, уравнение Аррениуса.
- •Энергия активации, энергетические диаграммы реакций. Влияние катализаторов на скорость реакций.
- •5. Химическое равновесие: кинетическое условие равновесия, факторы, влияющие на его состояние. Смещение равновесия (принцип Ле Шателье).
- •6. Константа химического равновесия (вывод; Кс, Кр, их взаимосвязь).
- •7. Зависимость констант скорости и химического равновесия от температуры. Уравнение изобары химической реакции.
- •8. Предмет, задачи, основные понятия и определения химической термодинамики (системы, параметры, функции).
- •9. Первый закон термодинамики; внутренняя энергия, энтальпия.
- •10. Применение первого закона термодинамики к изохорным и изобарным процессам. Тепловые эффекты химических реакций. Стандартные энтальпии образования веществ.
- •11. Законы термохимии (Гесса, Лавуазье–Лапласа). Расчет энергетических эффектов физико-химических процессов. Уравнение Кирхгофа.
- •12. Второй закон термодинамики. Энтропия (физический смысл; факторы, влияющие на величину энтропии). Изменение энтропии в различных физико-химических процессах.
- •13. Объединенное уравнение первого и второго законов термодинамики. Энергия Гиббса и энергия Гельмгольца.
- •14. Термодинамические критерии (энтальпийный и энтропийный факторы) возможности и направленности физико-химических процессов.
- •15. Термодинамическое условие состояние равновесия. Взаимосвязь свободной энергии Гиббса и константы равновесия. Уравнения изотермы и изобары химической реакции.
- •17. Растворы электролитов. Теория электролитической диссоциации. Кислоты, основания, соли в свете теории электролитической диссоциации.
- •18. Количественные характеристики растворов электролитов: степень и константа диссоциации; классификация электролитов. Степень диссоциации. Сильные и слабые электролиты
- •19. Сильные электролиты: активность ионов, коэффициент активности. Определение концентрации и активности ионов в растворах сильных электролитов.
- •20. Слабые электролиты: смещение равновесия в растворах слабых электролитов; степень и константа диссоциации, закон разбавления Оствальда.
- •21. Ионное произведение воды. Водородный (рН) и гидроксильный (рОн) показатели; их роль в различных физико–химических процессах.
- •22. Реакции обмена и гидролиза в растворах электролитов (ионно-молекулярные уравнения); степень и константа гидролиза.
- •23. Определение рН среды при гидролизе солей: по катиону, по аниону, по катиону и аниону.
- •24. Окислительно-восстановительные реакции: степень окисления; основные окислители и восстановители; способы составления уравнений овр (метод электродного баланса, электронно-ионный метод).
- •25. Электрохимические процессы и системы. Электродный потенциал и механизм его возникновения (двойной электрический слой). Условие протекания электрохимических окислительно-восстановительных реакций.
- •26. Электрод сравнения – водородный электрод. Определение величин стандартных электродных потенциалов. Электрохимический ряд напряжений.
- •27. Электроды 1-го рода (металлические и газовые). Расчет равновесных электродных потенциалов, уравнение Нернста.
- •28. Гальванические элементы: принцип действия, виды, основные характеристики (эдс, а мах, Кр , ∆g).
- •29. Химические и концентрационные гальванические элементы (схемы, уравнения электродных реакций, характеристики).
- •30. Явление поляризации и способы деполяризации в гальванических элементах.
- •31. Элемент Вольта (принцип действия, уравнения электродных реакций, эдс).
- •32. Общие закономерности процессов электролиза; факторы, определяющие характер и скорость электродных реакций.
- •33. Электролиз растворов и расплавов электролитов на инертных и активных электродах.
- •34. Поляризация и перенапряжение при электролизе. Эдс разложения.
- •35. Количественные законы электролиза – законы Фарадея (первый, второй, объединенный). Выход по току.
- •36. Химические источники тока: первичные, периодического действия (аккумуляторы), топливные элементы.
- •37. Применение процессов электролиза в технике (электрометаллургия, гальванотехника, оксидирование, электрорафинирование, хемотроника и др.).
- •38. Коррозия металлов: химическая и электрохимическая (общая характеристика, механизм протекания).
- •39. Электрохимическая коррозия металлов (причины и условия возникновения, механизм).
- •40. Коррозия с водородной и кислородной деполяризацией (условия протекания, способы замедления).
- •41. Электрохимическое и термодинамическое условия протекания коррозии, влияние вторичных продуктов коррозии на ее скорость.
- •42. Химические и электрохимические методы защиты металлов от коррозии (легирование, покрытия, протекторная и катодная защита).
- •43. Основные положения квантовой теории строения атома. Квантовые числа.
- •44. Электронные конфигурации атомов. Принцип Паули, правило Гунда. Принцип Паули: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
- •45. Структура многоэлектронных атомов. Принцип наименьшей энергии, правила Клечковского.
- •46. Общие положения теории химической связи (природа, условия образования, параметры). Ковалентная связь: способы образования, свойства.
- •47. Виды химической связи (ионная, металлическая, водородная) и их основные характеристики.
- •48. Металлы и их общая характеристика: химическая связь и структура, физические свойства, способы получения металлов.
- •49. Общие химические свойства металлов: взаимодействие с элементарными и сложными окислителями.
- •50. Элементарные полупроводники (положение в периодической системе элементов, общая характеристика); кремний и германий (нахождение в природе, способы получения, физические и химические свойства).
29. Химические и концентрационные гальванические элементы (схемы, уравнения электродных реакций, характеристики).
Зависимость величин электродных потенциалов от природы электродов и концентрации потенциалопределяющих ионов обусловливает существование химических и концентрационных гальванических элементов.
Химическим
называется гальванический элемент,
состоящий из двух электродов различной
природы. Примером химического
гальванического элемента служит элемент
Даниэля – Якоби. Он состоит из цинкового
( )
и медного (
)
и медного ( )
электродов (условия стандартные). Для
предотвращения прямого взаимодействия
окислителя и восстановителя и замыкания
внутренней цепи растворы электролитов
соединяются проводником 2-го рода
(электролитический мостик). При соединении
электродов металлическим проводником,
вследствие разности потенциалов (
)
электродов (условия стандартные). Для
предотвращения прямого взаимодействия
окислителя и восстановителя и замыкания
внутренней цепи растворы электролитов
соединяются проводником 2-го рода
(электролитический мостик). При соединении
электродов металлическим проводником,
вследствие разности потенциалов ( )
часть электронов с цинковой пластинки
перейдет на медную. Это нарушит равновесие
в двойном электрическом слое у цинка
(потенциал его повышается) и у меди
(потенциал ее понижается).
)
часть электронов с цинковой пластинки
перейдет на медную. Это нарушит равновесие
в двойном электрическом слое у цинка
(потенциал его повышается) и у меди
(потенциал ее понижается).
Обе
системы
и
стремятся
вернуть равновесие за счет окисления
цинка
 и восстановления ионов меди
и восстановления ионов меди
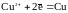 .
Этими процессами сохраняется разность
потенциалов, обеспечивающая постоянный
переход электронов по внешней цепи от
цинка к меди – электрический ток в
цепи. Во внутреннем участке цепи анионы
.
Этими процессами сохраняется разность
потенциалов, обеспечивающая постоянный
переход электронов по внешней цепи от
цинка к меди – электрический ток в
цепи. Во внутреннем участке цепи анионы
 перемещаются в растворе от медного
электрода к цинковому. Суммарное
уравнение токообразующей реакции
данного элемента имеет вид
перемещаются в растворе от медного
электрода к цинковому. Суммарное
уравнение токообразующей реакции
данного элемента имеет вид
 .
.
Процессы, описывающие работу гальванического элемента, представляются в виде схемы
А(–)
или |
А(–)
|
|
|
|
 = +0,34–(–0,76) = 1,1 В,
= +0,34–(–0,76) = 1,1 В,
где Е0 – стандартная электродвижущая сила (ЭДС) элемента, В.
Главным критерием возможности протекания электрохимических процессов в гальваническом элементе является положительный знак ЭДС, т.е. неравенство
E > 0, или φк > φа. |
(3.7) |
Концентрационный гальванический элемент – элемент, у которого оба электрода одинаковой природы в растворах с различной концентрацией ионов. Работает элемент за счет выравнивания концентрации растворов.
Например: концентрационный элемент составлен из двух металлических электродов
А(–) Ni│NiSO4║NiSO4│Ni (+)К
C1 < C2
А:
 ,
,
K:
 .
.
Возникающая при этом ЭДС зависит от соотношения концентраций ионов
, |
|
30. Явление поляризации и способы деполяризации в гальванических элементах.
ЭДС работающего гальванического элемента всегда меньше теоретически рассчитанной. Это обусловлено поляризацией электродов(и не только) – явление смещения величин электродных потенциалов от их равновесных значений. . Изменение потенциала электрода по сравнению с равновесным значением, вызванное изменением концентрации потенциалопределяющих ионов в растворе, называется концентрационной поляризацией. Поляризация, вызванная изменением химической природы электрода, называется химической.
Для
уменьшения поляризации используется
физическая деполяризация:
перемешивание раствора, механическое
удаление газа; а также химические
деполяризаторы: вещества, вступающие
в реакцию с продуктами, обусловливающими
поляризацию. Например, химическая
поляризация, вызванная выделением
водорода, снижается под действием
сильных окислителей (K2Cr2O7,
MnO2, O2 и др.).
Так, в элементе Вольта(Элемент Вольта
состоит из медного и цинкового электродов
в растворе серной кислоты. Схема его
записывается в виде А(–)
 К(+))
К(+))
при добавлении в катодное пространство K2Cr2O7 протекает окислительно-восстановительная реакция
K2Cr2O7 + 4 H2SO4 + 3 H2 = Cr2(SO4)3 + K2SO4 + 7 H2O,
в ионной форме

в результате водород окисляется и выводится из сферы электродной реакции, что приводит к увеличению ЭДС.



 (+)К
(+)К (+)К
(+)К


