
- •Предмет и основные понятия химической кинетики (система; фаза; процессы и их классификация; скорость и факторы, влияющие на скорость гомогенных и гетерогенных реакций).
- •Зависимость скорости химических реакций от концентраций (парциальных давлений) реагирующих веществ. Закон действия масс, константа скорости.
- •3. Влияние температуры на скорость химических реакций: правило Вант-Гоффа, уравнение Аррениуса.
- •Энергия активации, энергетические диаграммы реакций. Влияние катализаторов на скорость реакций.
- •5. Химическое равновесие: кинетическое условие равновесия, факторы, влияющие на его состояние. Смещение равновесия (принцип Ле Шателье).
- •6. Константа химического равновесия (вывод; Кс, Кр, их взаимосвязь).
- •7. Зависимость констант скорости и химического равновесия от температуры. Уравнение изобары химической реакции.
- •8. Предмет, задачи, основные понятия и определения химической термодинамики (системы, параметры, функции).
- •9. Первый закон термодинамики; внутренняя энергия, энтальпия.
- •10. Применение первого закона термодинамики к изохорным и изобарным процессам. Тепловые эффекты химических реакций. Стандартные энтальпии образования веществ.
- •11. Законы термохимии (Гесса, Лавуазье–Лапласа). Расчет энергетических эффектов физико-химических процессов. Уравнение Кирхгофа.
- •12. Второй закон термодинамики. Энтропия (физический смысл; факторы, влияющие на величину энтропии). Изменение энтропии в различных физико-химических процессах.
- •13. Объединенное уравнение первого и второго законов термодинамики. Энергия Гиббса и энергия Гельмгольца.
- •14. Термодинамические критерии (энтальпийный и энтропийный факторы) возможности и направленности физико-химических процессов.
- •15. Термодинамическое условие состояние равновесия. Взаимосвязь свободной энергии Гиббса и константы равновесия. Уравнения изотермы и изобары химической реакции.
- •17. Растворы электролитов. Теория электролитической диссоциации. Кислоты, основания, соли в свете теории электролитической диссоциации.
- •18. Количественные характеристики растворов электролитов: степень и константа диссоциации; классификация электролитов. Степень диссоциации. Сильные и слабые электролиты
- •19. Сильные электролиты: активность ионов, коэффициент активности. Определение концентрации и активности ионов в растворах сильных электролитов.
- •20. Слабые электролиты: смещение равновесия в растворах слабых электролитов; степень и константа диссоциации, закон разбавления Оствальда.
- •21. Ионное произведение воды. Водородный (рН) и гидроксильный (рОн) показатели; их роль в различных физико–химических процессах.
- •22. Реакции обмена и гидролиза в растворах электролитов (ионно-молекулярные уравнения); степень и константа гидролиза.
- •23. Определение рН среды при гидролизе солей: по катиону, по аниону, по катиону и аниону.
- •24. Окислительно-восстановительные реакции: степень окисления; основные окислители и восстановители; способы составления уравнений овр (метод электродного баланса, электронно-ионный метод).
- •25. Электрохимические процессы и системы. Электродный потенциал и механизм его возникновения (двойной электрический слой). Условие протекания электрохимических окислительно-восстановительных реакций.
- •26. Электрод сравнения – водородный электрод. Определение величин стандартных электродных потенциалов. Электрохимический ряд напряжений.
- •27. Электроды 1-го рода (металлические и газовые). Расчет равновесных электродных потенциалов, уравнение Нернста.
- •28. Гальванические элементы: принцип действия, виды, основные характеристики (эдс, а мах, Кр , ∆g).
- •29. Химические и концентрационные гальванические элементы (схемы, уравнения электродных реакций, характеристики).
- •30. Явление поляризации и способы деполяризации в гальванических элементах.
- •31. Элемент Вольта (принцип действия, уравнения электродных реакций, эдс).
- •32. Общие закономерности процессов электролиза; факторы, определяющие характер и скорость электродных реакций.
- •33. Электролиз растворов и расплавов электролитов на инертных и активных электродах.
- •34. Поляризация и перенапряжение при электролизе. Эдс разложения.
- •35. Количественные законы электролиза – законы Фарадея (первый, второй, объединенный). Выход по току.
- •36. Химические источники тока: первичные, периодического действия (аккумуляторы), топливные элементы.
- •37. Применение процессов электролиза в технике (электрометаллургия, гальванотехника, оксидирование, электрорафинирование, хемотроника и др.).
- •38. Коррозия металлов: химическая и электрохимическая (общая характеристика, механизм протекания).
- •39. Электрохимическая коррозия металлов (причины и условия возникновения, механизм).
- •40. Коррозия с водородной и кислородной деполяризацией (условия протекания, способы замедления).
- •41. Электрохимическое и термодинамическое условия протекания коррозии, влияние вторичных продуктов коррозии на ее скорость.
- •42. Химические и электрохимические методы защиты металлов от коррозии (легирование, покрытия, протекторная и катодная защита).
- •43. Основные положения квантовой теории строения атома. Квантовые числа.
- •44. Электронные конфигурации атомов. Принцип Паули, правило Гунда. Принцип Паули: в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковы.
- •45. Структура многоэлектронных атомов. Принцип наименьшей энергии, правила Клечковского.
- •46. Общие положения теории химической связи (природа, условия образования, параметры). Ковалентная связь: способы образования, свойства.
- •47. Виды химической связи (ионная, металлическая, водородная) и их основные характеристики.
- •48. Металлы и их общая характеристика: химическая связь и структура, физические свойства, способы получения металлов.
- •49. Общие химические свойства металлов: взаимодействие с элементарными и сложными окислителями.
- •50. Элементарные полупроводники (положение в периодической системе элементов, общая характеристика); кремний и германий (нахождение в природе, способы получения, физические и химические свойства).
33. Электролиз растворов и расплавов электролитов на инертных и активных электродах.
Катодные процессы
На катоде могут
восстанавливаться:
катионы
 ,
ионы
,
ионы
 (рН < 7),
молекулы H2O
(рН ≥ 7). Определяя
процесс, идущий на катоде, в первую
очередь надо установить возможность
восстановления катиона металла.
При сопоставимой концентрации частиц
ряд напряжений металлов по восстановительной
способности их ионов условно разбивается
на три группы.
(рН < 7),
молекулы H2O
(рН ≥ 7). Определяя
процесс, идущий на катоде, в первую
очередь надо установить возможность
восстановления катиона металла.
При сопоставимой концентрации частиц
ряд напряжений металлов по восстановительной
способности их ионов условно разбивается
на три группы.
1. Катионы активных металлов от Li до Al включительно из водных растворов не восстанавливаются, ВТ (Ме) = 0, а восстанавливается водород по уравнениям
 (
( )
или
)
или  (
( ).
).
2. Катионы
металлов средней активности от Mn
до Н
восстанавливаются наряду с водородом,
ВТ (Ме) < 100 %
( )
)
 –
основная реакция;
–
основная реакция;
( ) – побочная реакция;
 (
)
– побочная реакция.
(
)
– побочная реакция.
3. Катионы малоактивных металлов, стоящих в ряду напряжений после Н, восстанавливаются без участия водорода по уравнению
 ,
ВТ (Ме) 100 %.
,
ВТ (Ме) 100 %.
Анодные процессы
На аноде могут окисляться: анионы электролита, молекулы Н2О (рН < 7), ионы ОН– (рН > 7), металл анода.
Характер окислительных процессов определяется прежде всего материалом анода. В случае инертного (нерастворимого) анода на нем идут процессы окисления частиц электролита в следующей последовательности:
1. Сложные
кислородсодержащие анионы (
,
 ,
,
и др.) и анион F- из водных растворов
не окисляются. В зависимости от характера
среды идут реакции:
,
,
и др.) и анион F- из водных растворов
не окисляются. В зависимости от характера
среды идут реакции:
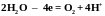 (
( )
или
)
или  (
( ).
).
2. Простые
анионы
( ,
,
 ,
,
 ,
,
 и др.) окисляются без участия кислорода:
и др.) окисляются без участия кислорода:
 ,
,
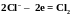
Примечание.
Чем
меньше потенциал, тем легче происходит
окисление, при этом окисление хлора
( В)
происходит за счет большего перенапряжения
кислорода (
В)
происходит за счет большего перенапряжения
кислорода (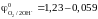 рН).
рН).
При использовании активного (растворимого) анода (из меди, цинка, никеля, серебра и других металлов) окисляется материал самого анода:
|

34. Поляризация и перенапряжение при электролизе. Эдс разложения.
Электролиз — это окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через раствор или расплав электролитов.
Химическая поляризация – связана с процессами, изменяющими химический состав поверхности электродов.
Концентрационная поляризация – возникает за счет неодинакового изменения концентраций электрохимически активных веществ в тонком слое раствора, прилежащего к поверхности электродов.
В связи с поляризацией необходимо дополнительное повышение напряжения на клеммах электролизера, чтобы он работал бесперебойно. Вот почему на практике всегда принимают меры для деполяризации, т. е. уменьшения или почти полного устранения поляризации.
Для того чтобы протекал процесс электролиза, разность потенциалов, приложенная к электродам, должна быть не меньше некоторой определенной величины, характерной для этого процесса.
Наименьшая разность потенциалов, необходимая для проведения данного процесса электролиза, называется потенциалом разложения или напряжением разложения. Эта величина обычно выражается в вольтах и равна э. д. с. элемента, построенного на продуктах электролиза.
Разность между опытным (экспериментальным) и теоретическим значением потенциала разложения называют перенапряжением. Иначе, перенапряжением называют разность между потенциалом разложения, действительно необходимым для протекания электролиза в данной электрохимической системе, и э. д. с. гальванического элемента, отвечающего этой системе.
ЭДС разложения:


 –
–
 =
=
 .
.