
- •Н.В. Стулин, м.Н. Земцова, и.К. Моисеев
- •Углеводороды
- •Текст лекций по органической химии
- •Самара 2004
- •Гомологический ряд
- •Изомерия
- •Номенклатура
- •Рациональная номенклатура
- •Систематическая номенклатура (iupac)
- •Способы получения алканов
- •Промышленные методы
- •1. Метод Бергиуса (гидрогенизация бурых углей):
- •2. Метод Фишера-Тропша:
- •Лабораторные методы
- •3. Декарбоксилирование солей карбоновых кислот:
- •4. Гидрирование алкенов:
- •5. Восстановление галоидных алкилов:
- •Физические свойства алканов
- •Строение алканов
- •Химические свойства алканов
- •Реакции замещения
- •Общие проблемы галогенирования алканов
- •Реакции окисления
- •Мягкое окисление
- •Реакция расщепления (крекинг и пиролиз)
- •Отдельные представители
- •Лекция №3. Алкены
- •Гомологический ряд. Изомерия
- •Номенклатура
- •Промышленные источники алкенов
- •Методы синтеза алкенов
- •3. Дегалогенирование вицинальных дигалогенидов:
- •Физические свойства алкенов
- •Физические свойства некоторых этиленовых углеводородов приведены в табл.3.2
- •Строение алкенов
- •Химические свойства Гетерогенное каталитическое гидрирование
- •Реакции электрофильного присоединения
- •2. Присоединение галогеноводородных кислот (гидрогалогенирование):
- •Реакции радикального присоединения
- •Реакции окисления
- •1. Эпоксидирование (реакция Прилежаева):
- •2. Гидроксилирование (образование гликолей, реакция Вагнера):
- •Реакции по -углеродному атому
- •Полимеризация
- •Отдельные представители
- •Гомологический ряд диенов
- •Синтез изопрена
- •Синтез хлоропрена:
- •Лекция №6. Строение и химические свойства диенов
- •Строение и свойства алленов
- •1. Галогенирование:
- •2. Гидрогалогенирование:
- •3. Гидратация:
- •Строение сопряженных диенов
- •Химические свойства сопряженных диенов
- •5. Окисление:
- •Димеризация
- •Полимеризация
- •Гомологический ряд
- •Изомерия
- •Промышленные способы получения ацетилена
- •Из карбида кальция
- •Пиролиз метана.
- •Лабораторные способы получения ацетилена и его гомологов
- •1. Реакция дегидрогалогенирования:
- •Физические свойства
- •Строение алкинов
- •Химические свойства
- •Реакции присоединения
- •Присоединение воды к алкинам.
- •Отдельные представители
- •Строение бензола
- •Изомерия
- •Номенклатура
- •Методы получения
- •Промышленные источники
- •2. Нефть.
- •3. Из алкинов (Реппе, Зелинский):
- •Лабораторные способы
- •Лекция №10. Химические свойства арОматических углеводородов
- •Механизм реакций электрофильного замещения
- •Реакции электрофильного замещения
- •1. Нитрование:
- •2. Галогенирование:
- •3. Сульфирование. Для сульфирования часто применяется серная кислота, содержащая избыток so3 (олеум). Кислотно-основное равновесие между двумя молекулами серной кислоты:
- •Реакции окисления
- •3. Озонолиз:
- •4. Каталитическое окисление о2 в присутствии медного катализатора.
- •Влияние заместителей в бензольном ядре на электрофильное замещение
- •Распределение изомеров при нитровании производных бензола
- •Электрофильное замещение в дизамещенных бензолах
- •Отдельные представители
- •Нафталин
- •Изомерия, номенклатура
- •Способы получения
- •Структура нафталина
- •Химические свойства
- •Осторожное окисление нафталина и его гомологов приводит к потере ароматичности с образованием хинонов (в отличие от гомологов бензола):
- •Ориентация электрофильного замещения в нафталине
- •Антрацен и фенантрен
- •Гексафенилэтан
- •Библиографический список Основной
- •Дополнительный
- •Содержание
Методы получения
Способы получения бензола и его производных делятся на промышленные и лабораторные.
Промышленные источники
1. Каменноугольная смола, получаемая из каменного угля. Кокс- металлургия. Каменный уголь- первый источник ароматических углеводородов.
Легкое масло (80-170°С)- бензол, толуол.
Среднее масло (170-240°С) - фенол, крезолы.
Тяжелое масло (240-270°С) - нафтолы.
Антраценовое масло 270 С.
Пек - остаток.
2. Нефть.
Ароматизация нефти.

Велика в решении этой проблемы роль школы химиков Б.А. Казанского, А.Ф. Платэ и др. ИОХ АН СССР МГУ.

3. Из алкинов (Реппе, Зелинский):
Лабораторные способы
Вюрца-Фиттига:

Алкилирование (подробно расмотрено в разделе химических свойств)
Лекция №10. Химические свойства арОматических углеводородов
Реакции электрофильного замещения: галогенирование, нитрование, сульфирование, алкилирование, ацилирование. Реакции окисления бензола и его гомологов. Механизм реакции электрофильного замещения. Понятие о - и -комплексах, их строение. Энергетическая диаграмма. Влияние заместителей на направление и скорость электрофильного замещения. Особенности влияния галогенов. Электрофильное замещение в дизамещенных бензолах. Отдельные представители.
Механизм реакций электрофильного замещения
В силу строения бензольного кольца для ароматических соединений ряда бензола характерны реакции электрофильного замещения.
1 Стадия – атака электрофилом, образование -комплекса и -комплекса:

2 Стадия – стабилизация - комплекса:

Стабилизация - комплекса за счет отщепления протона – энергетически более выгодный процесс, чем присоединение нуклеофильной частицы, так как в этом случае восстанавливается ароматичность системы:

Энергетический профиль реакции ароматического электрофильного замещения имеет следующий вид:

Реакции электрофильного замещения
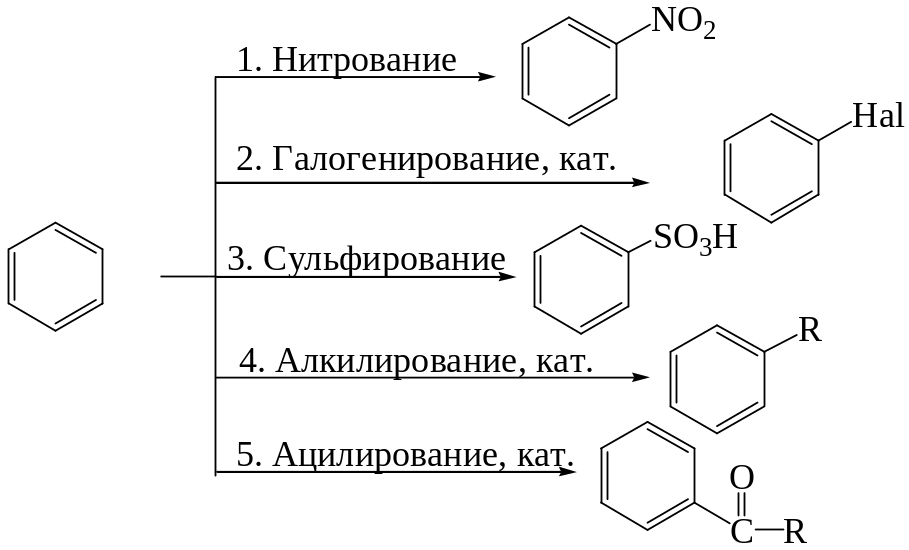
1. Нитрование:

Нитрующие агенты: HNO3, HNO3/H2SO4, HNO3/CH3COOH, HNO3/(CH3CO)2O, NO2BF4 и др.
Природа нитрующих агентов (образование нитрующей частицы):
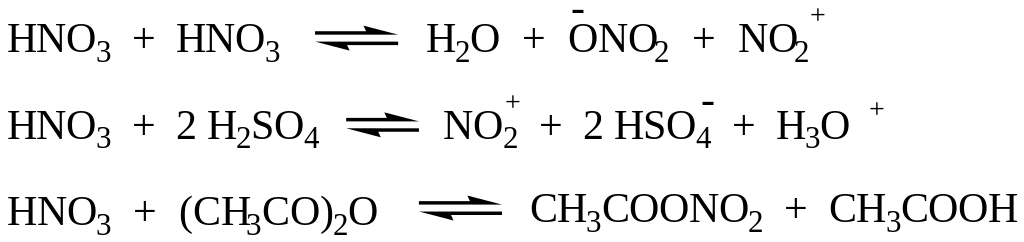
2. Галогенирование:

Образование электрофильной частицы:
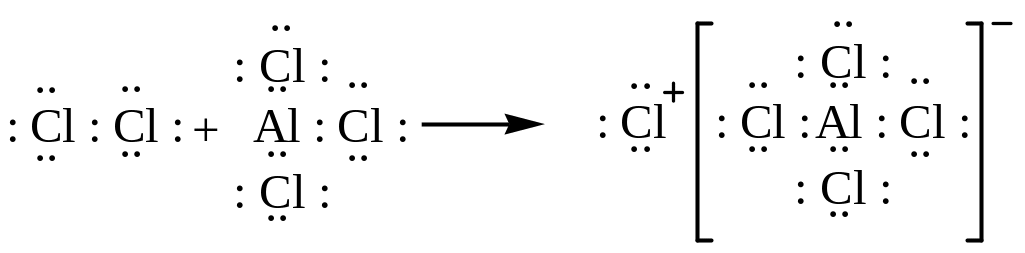
3. Сульфирование. Для сульфирования часто применяется серная кислота, содержащая избыток so3 (олеум). Кислотно-основное равновесие между двумя молекулами серной кислоты:
![]()
Хотя серный ангидрид не несет положительного заряда, но он обладает дефицитом электронов и, следовательно, является кислотой.

Поскольку бензолсульфокислота является сильной кислотой, то она легко диссоциирует с отрывом протона. Реакция сульфирования – обратимая. При взаимодействии бензолсульфокислоты с перегретым водяным паром при 180С образуется бензол.
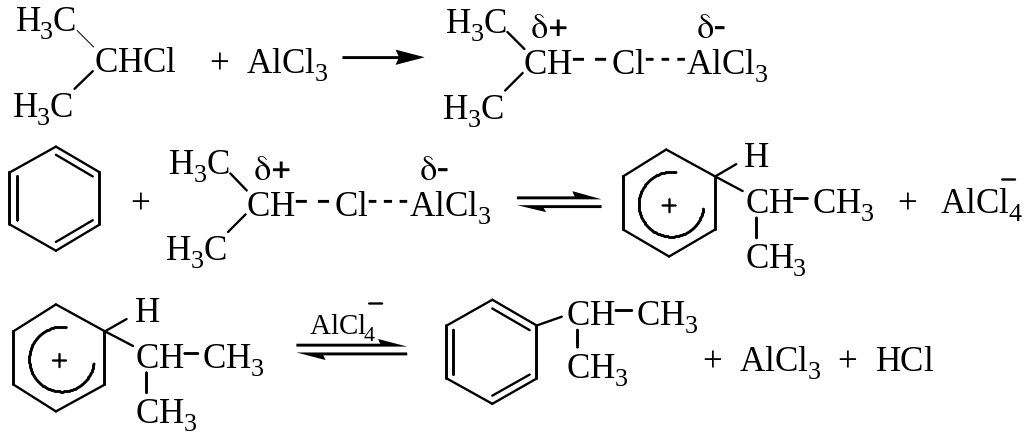
4. Алкилирование по Фриделю – Крафтсу. Принято два возможных механизма протекания реакции. В первом случае электрофильной частицей является карбокатион, образующийся в результате взаимодействия галогеналкана с хлоридом алюминия (кислотой Льюиса):
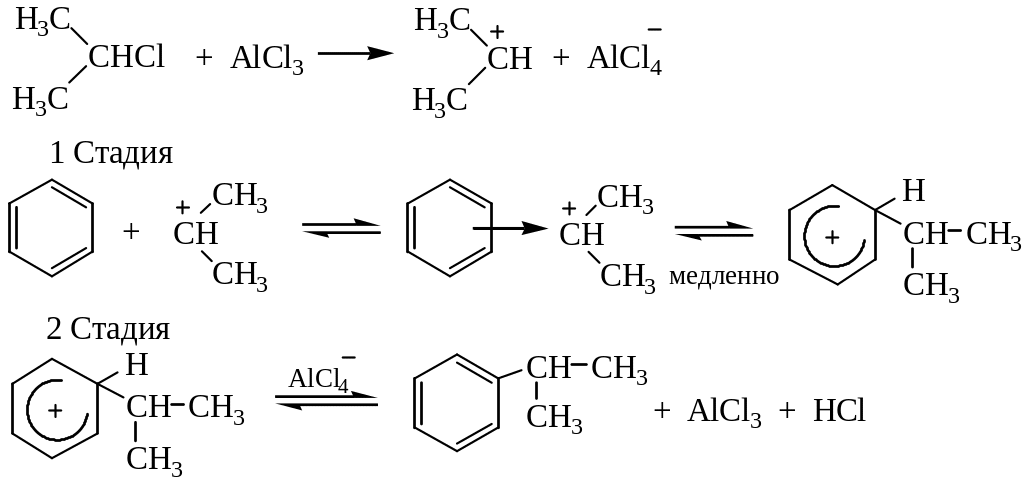
Во втором случае можно предполагать, что электрофилом служит алкильная группа полярного комплекса AlCl3 с алкилгалогенидом.
Реакции окисления
1. Бензольное кольцо в обычных условиях с трудом окисляется в присутствии пятиокиси ванадия V2O5:
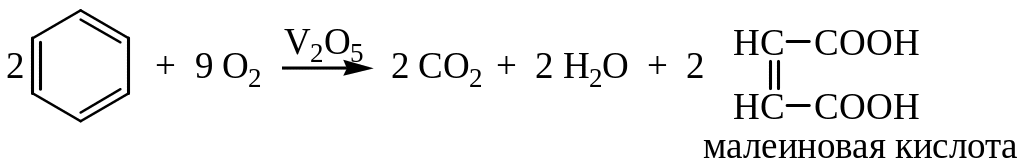
2. Окисление алкилпроизводных бензола идет с образованием карбоксилсодержащих бензольных производных:



