
- •Н.В. Стулин, м.Н. Земцова, и.К. Моисеев
- •Углеводороды
- •Текст лекций по органической химии
- •Самара 2004
- •Гомологический ряд
- •Изомерия
- •Номенклатура
- •Рациональная номенклатура
- •Систематическая номенклатура (iupac)
- •Способы получения алканов
- •Промышленные методы
- •1. Метод Бергиуса (гидрогенизация бурых углей):
- •2. Метод Фишера-Тропша:
- •Лабораторные методы
- •3. Декарбоксилирование солей карбоновых кислот:
- •4. Гидрирование алкенов:
- •5. Восстановление галоидных алкилов:
- •Физические свойства алканов
- •Строение алканов
- •Химические свойства алканов
- •Реакции замещения
- •Общие проблемы галогенирования алканов
- •Реакции окисления
- •Мягкое окисление
- •Реакция расщепления (крекинг и пиролиз)
- •Отдельные представители
- •Лекция №3. Алкены
- •Гомологический ряд. Изомерия
- •Номенклатура
- •Промышленные источники алкенов
- •Методы синтеза алкенов
- •3. Дегалогенирование вицинальных дигалогенидов:
- •Физические свойства алкенов
- •Физические свойства некоторых этиленовых углеводородов приведены в табл.3.2
- •Строение алкенов
- •Химические свойства Гетерогенное каталитическое гидрирование
- •Реакции электрофильного присоединения
- •2. Присоединение галогеноводородных кислот (гидрогалогенирование):
- •Реакции радикального присоединения
- •Реакции окисления
- •1. Эпоксидирование (реакция Прилежаева):
- •2. Гидроксилирование (образование гликолей, реакция Вагнера):
- •Реакции по -углеродному атому
- •Полимеризация
- •Отдельные представители
- •Гомологический ряд диенов
- •Синтез изопрена
- •Синтез хлоропрена:
- •Лекция №6. Строение и химические свойства диенов
- •Строение и свойства алленов
- •1. Галогенирование:
- •2. Гидрогалогенирование:
- •3. Гидратация:
- •Строение сопряженных диенов
- •Химические свойства сопряженных диенов
- •5. Окисление:
- •Димеризация
- •Полимеризация
- •Гомологический ряд
- •Изомерия
- •Промышленные способы получения ацетилена
- •Из карбида кальция
- •Пиролиз метана.
- •Лабораторные способы получения ацетилена и его гомологов
- •1. Реакция дегидрогалогенирования:
- •Физические свойства
- •Строение алкинов
- •Химические свойства
- •Реакции присоединения
- •Присоединение воды к алкинам.
- •Отдельные представители
- •Строение бензола
- •Изомерия
- •Номенклатура
- •Методы получения
- •Промышленные источники
- •2. Нефть.
- •3. Из алкинов (Реппе, Зелинский):
- •Лабораторные способы
- •Лекция №10. Химические свойства арОматических углеводородов
- •Механизм реакций электрофильного замещения
- •Реакции электрофильного замещения
- •1. Нитрование:
- •2. Галогенирование:
- •3. Сульфирование. Для сульфирования часто применяется серная кислота, содержащая избыток so3 (олеум). Кислотно-основное равновесие между двумя молекулами серной кислоты:
- •Реакции окисления
- •3. Озонолиз:
- •4. Каталитическое окисление о2 в присутствии медного катализатора.
- •Влияние заместителей в бензольном ядре на электрофильное замещение
- •Распределение изомеров при нитровании производных бензола
- •Электрофильное замещение в дизамещенных бензолах
- •Отдельные представители
- •Нафталин
- •Изомерия, номенклатура
- •Способы получения
- •Структура нафталина
- •Химические свойства
- •Осторожное окисление нафталина и его гомологов приводит к потере ароматичности с образованием хинонов (в отличие от гомологов бензола):
- •Ориентация электрофильного замещения в нафталине
- •Антрацен и фенантрен
- •Гексафенилэтан
- •Библиографический список Основной
- •Дополнительный
- •Содержание
3. Декарбоксилирование солей карбоновых кислот:
300-400C
СН3СН2COONa + NaOH CH3CH3 + NaHCO3
4. Гидрирование алкенов:
Pd, Pt или Ni
СН3СН=CH2 + H2 CH3CH2CH3
5. Восстановление галоидных алкилов:
[H]
CH3CH2CH2Br CH3CH2CH3 + HBr
6. Разложение реактивов Гриньяра соединениями, содержащими подвижный водород:
HOH
CH3CH2Br + Mg CH3CH2MgBr CH3CH3 + MgOHBr
Физические свойства алканов
Физические свойства веществ зависят от их состава и строения.
Четыре первых члена гомологического ряда предельных углеводородов - вещества газообразные.
Начиная с пентана и выше нормальные углеводороды представляют собой жидкости, а с углеводорода С16Н34 высшие гомологи при обычной температуре - твердые вещества.
Температура кипения всех изоалканов ниже, чем нормальных алканов, причем тем ниже, чем более разветвлена цепь молекулы.
Относительная плотность алканов лежит в интервале 0,416 - 0,816 г/см3.
Парафины не растворимы в воде, в спирте же и эфире растворяются хорошо; с усложнением состава растворимость в спирте уменьшается.
Лекция №2. Строение и химические свойства алканов
Строение алканов. Состояние атома углерода. Модель молекулы метана. Конформации. Химические свойства алканов: реакции галогенирования, нитрования и др. Механизмы реакций. Окисление алканов. Крекинг и пиролиз. Отдельные представители.
Строение алканов
Углерод в насыщенных углеводородах находится в sp3 – гибридизованном состоянии. Для алканов характерны 2 вида -связей – С-Н и С-С:
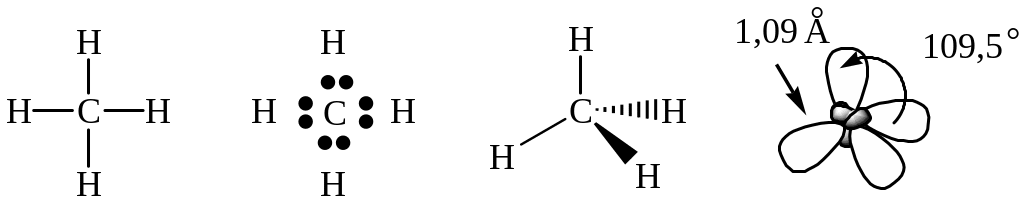
Как и любая ковалентная связь, связь в углеводородах характеризуется энергией, длиной, полярностью и направленностью. Угол и длина связей приведены на рисунке:
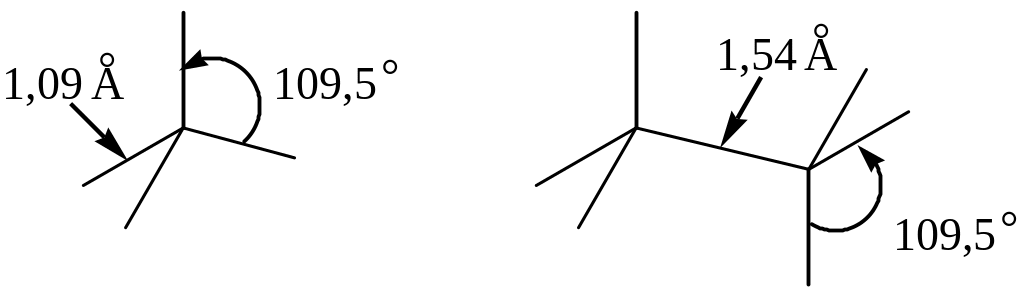
Энергия связи С-Н составляет 413,7 кДж/моль (105 ккал/моль), а энергия С-С - 350 кДж/моль (85 ккал/моль).
Нормальная цепь насыщенного углеводорода имеет вид
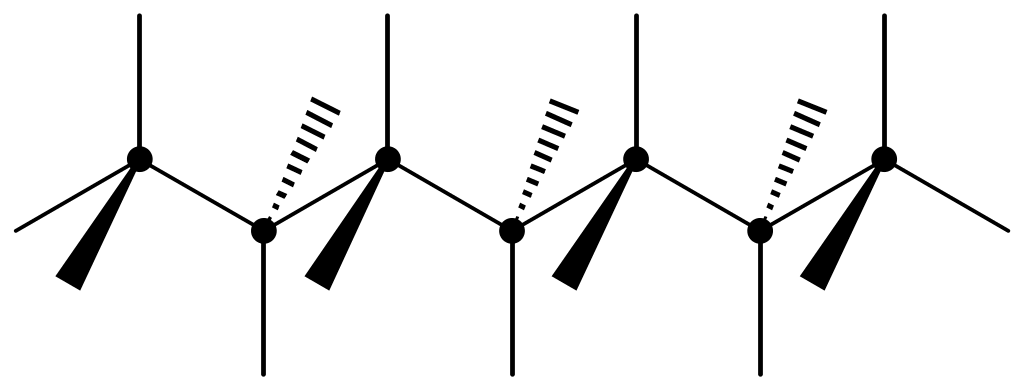
Свободное вращение атомов относительно связи С-С возможно благодаря форме орбитали. При вращении перекрывание орбиталей не нарушается.
Различные расположения атомов в молекуле алкана, которые могут взаимно превращаться друг в друга путем вращения вокруг С-С связи, называются конформациями. Энергия, необходимая для вращения, называется торсионной энергией (для этана – 3 ккал/моль или 12,56 Дж/моль).
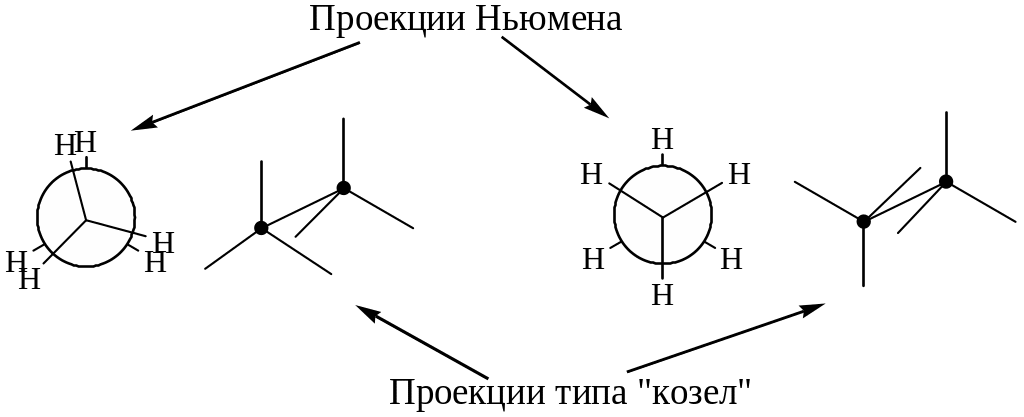
Благодаря возможности свободного вращения относительно связи С-С, для углеводородов существуют две конформации - заслоненная и заторможенная.
Для этана они изображаются следующим образом:
Заторможенные конформации бутана неодинаковы. Чтобы различить их между собой, конформер А называют анти-конформером, а конформеры Б и В – гош-конформерами:

Так как молекула алкана неполярна, то между атомами существуют только Ван-дер-Ваальсовы силы взаимодействия. Электростатические силы притяжения между молекулами отсутствуют.
Конформации пентана:
Химические свойства алканов
Химические свойства алканов определяются природой химической связи и строением.
Для алканов характерны реакции замещения (S), отщепления (E), расщепления, окисления.
