
- •Н.В. Стулин, м.Н. Земцова, и.К. Моисеев
- •Углеводороды
- •Текст лекций по органической химии
- •Самара 2004
- •Гомологический ряд
- •Изомерия
- •Номенклатура
- •Рациональная номенклатура
- •Систематическая номенклатура (iupac)
- •Способы получения алканов
- •Промышленные методы
- •1. Метод Бергиуса (гидрогенизация бурых углей):
- •2. Метод Фишера-Тропша:
- •Лабораторные методы
- •3. Декарбоксилирование солей карбоновых кислот:
- •4. Гидрирование алкенов:
- •5. Восстановление галоидных алкилов:
- •Физические свойства алканов
- •Строение алканов
- •Химические свойства алканов
- •Реакции замещения
- •Общие проблемы галогенирования алканов
- •Реакции окисления
- •Мягкое окисление
- •Реакция расщепления (крекинг и пиролиз)
- •Отдельные представители
- •Лекция №3. Алкены
- •Гомологический ряд. Изомерия
- •Номенклатура
- •Промышленные источники алкенов
- •Методы синтеза алкенов
- •3. Дегалогенирование вицинальных дигалогенидов:
- •Физические свойства алкенов
- •Физические свойства некоторых этиленовых углеводородов приведены в табл.3.2
- •Строение алкенов
- •Химические свойства Гетерогенное каталитическое гидрирование
- •Реакции электрофильного присоединения
- •2. Присоединение галогеноводородных кислот (гидрогалогенирование):
- •Реакции радикального присоединения
- •Реакции окисления
- •1. Эпоксидирование (реакция Прилежаева):
- •2. Гидроксилирование (образование гликолей, реакция Вагнера):
- •Реакции по -углеродному атому
- •Полимеризация
- •Отдельные представители
- •Гомологический ряд диенов
- •Синтез изопрена
- •Синтез хлоропрена:
- •Лекция №6. Строение и химические свойства диенов
- •Строение и свойства алленов
- •1. Галогенирование:
- •2. Гидрогалогенирование:
- •3. Гидратация:
- •Строение сопряженных диенов
- •Химические свойства сопряженных диенов
- •5. Окисление:
- •Димеризация
- •Полимеризация
- •Гомологический ряд
- •Изомерия
- •Промышленные способы получения ацетилена
- •Из карбида кальция
- •Пиролиз метана.
- •Лабораторные способы получения ацетилена и его гомологов
- •1. Реакция дегидрогалогенирования:
- •Физические свойства
- •Строение алкинов
- •Химические свойства
- •Реакции присоединения
- •Присоединение воды к алкинам.
- •Отдельные представители
- •Строение бензола
- •Изомерия
- •Номенклатура
- •Методы получения
- •Промышленные источники
- •2. Нефть.
- •3. Из алкинов (Реппе, Зелинский):
- •Лабораторные способы
- •Лекция №10. Химические свойства арОматических углеводородов
- •Механизм реакций электрофильного замещения
- •Реакции электрофильного замещения
- •1. Нитрование:
- •2. Галогенирование:
- •3. Сульфирование. Для сульфирования часто применяется серная кислота, содержащая избыток so3 (олеум). Кислотно-основное равновесие между двумя молекулами серной кислоты:
- •Реакции окисления
- •3. Озонолиз:
- •4. Каталитическое окисление о2 в присутствии медного катализатора.
- •Влияние заместителей в бензольном ядре на электрофильное замещение
- •Распределение изомеров при нитровании производных бензола
- •Электрофильное замещение в дизамещенных бензолах
- •Отдельные представители
- •Нафталин
- •Изомерия, номенклатура
- •Способы получения
- •Структура нафталина
- •Химические свойства
- •Осторожное окисление нафталина и его гомологов приводит к потере ароматичности с образованием хинонов (в отличие от гомологов бензола):
- •Ориентация электрофильного замещения в нафталине
- •Антрацен и фенантрен
- •Гексафенилэтан
- •Библиографический список Основной
- •Дополнительный
- •Содержание
Реакции окисления
Углеводороды - источник энергии. При полном сгорании углеводородов в избытке кислорода образуются углекислый газ и вода, а также выделяется тепло (Q - теплота сгорания)
CnH2n+2 + изб. О2 n CO2 + (n + 1) H2O + Q
Пример:
С5Н12 + 8 О2 5 СО2 + 6 Н2О + 845 ккал/моль
Q = 845 ккал/моль
Реакция полного окисления (сгорания) алканов используется в двигателях внутреннего сгорания, поэтому расчет теплового эффекта этого процесса весьма важен.
Теплота сгорания Q – это теплота реакции сгорания углеводорода. Для ее расчета необходимо знать теплоту образования исходных алканов.
Теплота образования
Теплотой образования (Нf) соединения называется изменение энтальпии, которое происходит при образовании 1 моля этого соединения из его составляющих. Это разница между энтальпией вещества и суммой энтальпий элементов, из которых оно состоит. Для этана теплота образования
Нf этана = Н этана - (2Н углерода + 3Н водорода),
т.е. молярная теплота образования этана = энтальпия 1 моль этана - (энтальпия 2 атомов углерода + энтальпия 3 моль газообразного водорода).
Для элементов в стандартном состоянии (комнатная температура и атмосферное давление) энтальпия равна нулю, тогда теплосодержание равно теплоте его образования. Теплота образования СН4 и NO2 приведена на рисунке:
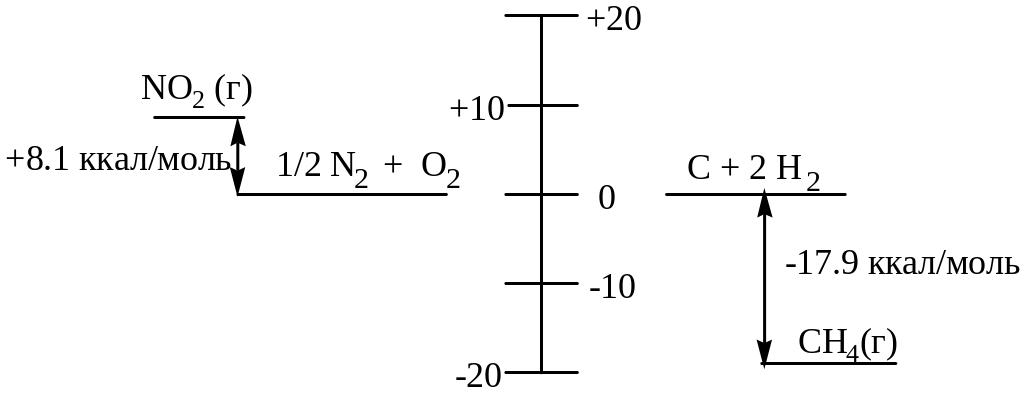
Теплота реакции
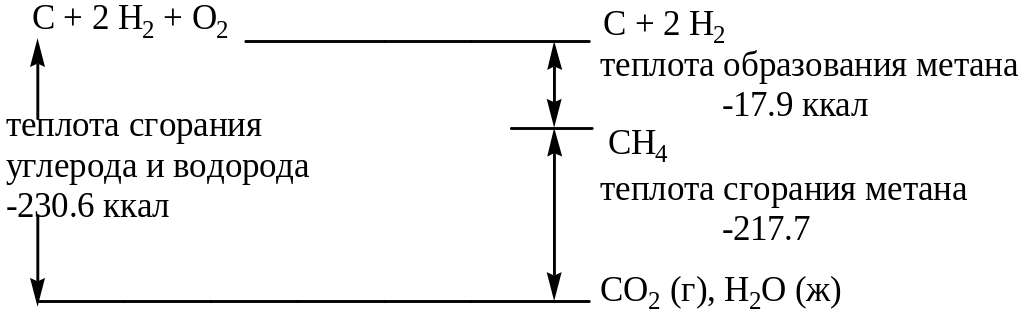
Теплота реакции равна изменению энтальпии (Н) в ходе реакции. В свою очередь изменение энтальпии, сопровождающее реакции, равно разности теплоты образования продуктов и теплоты образования исходных веществ.
Если Н - отрицательная величина, реакция экзотермическая (выделяется тепло); если Н - положительная величина, реакция эндотермическая (поглощается тепло).
Н = Нf продуктов - Нf исходных веществ
Качество моторного топлива (бензина) определяется его антидетонационными свойствами. Относительная антидетонационная способность топлива обычно характеризуется так называемым октановым числом. Чем выше октановое число, тем лучше бензин. Антидетонационные свойства зависят от строения углеводорода, т.е. от степени его разветвленности (табл. 2.3).
Таблица 2.3
Октановое число |
||
н-Гептан |
0 |
Детонирует |
2,2,4-триметилпентан |
100 |
Не детонирует |
Разветвленные алканы и алкены, ароматические углеводороды обладают хорошими антидетонирующими свойствами. Их получают каталитическим крекингом, каталитическим риформингом. Сильно разветвленные алкены получают из алкенов и алканов реакцией алкилирования.
Бензиновую фракцию (бензин прямой перегонки) улучшают добавлением соединений с более высоким октановым числом.
Таким образом, проблему повышения октанового числа решают а) выбором соответствующего углеводорода; б) добавлением тетраэтилсвинца Pb(C2H5)4 - этилирование бензина (0,2 - 0,8 мг/л); в) созданием топлив с высоким октановым числом.
Мягкое окисление
Окисление высших парафинов проводят при температуре порядка 150С в присутствии катализаторов, например соединений марганца. При этом получают смесь кислот с различной длиной цепи, оксикислоты, кетокислоты, сложные эфиры, спирты, кетоны и т.д. Важнейшим промышленным применением жидкофазного процесса окисления является производство уксусной кислоты из бутана (катализаторы - хром, кобальт, свинец):

В процессе окисления предельных углеводородов в качестве промежуточных продуктов образуются органические гидроперекиси.
