
- •Н.В. Стулин, м.Н. Земцова, и.К. Моисеев
- •Углеводороды
- •Текст лекций по органической химии
- •Самара 2004
- •Гомологический ряд
- •Изомерия
- •Номенклатура
- •Рациональная номенклатура
- •Систематическая номенклатура (iupac)
- •Способы получения алканов
- •Промышленные методы
- •1. Метод Бергиуса (гидрогенизация бурых углей):
- •2. Метод Фишера-Тропша:
- •Лабораторные методы
- •3. Декарбоксилирование солей карбоновых кислот:
- •4. Гидрирование алкенов:
- •5. Восстановление галоидных алкилов:
- •Физические свойства алканов
- •Строение алканов
- •Химические свойства алканов
- •Реакции замещения
- •Общие проблемы галогенирования алканов
- •Реакции окисления
- •Мягкое окисление
- •Реакция расщепления (крекинг и пиролиз)
- •Отдельные представители
- •Лекция №3. Алкены
- •Гомологический ряд. Изомерия
- •Номенклатура
- •Промышленные источники алкенов
- •Методы синтеза алкенов
- •3. Дегалогенирование вицинальных дигалогенидов:
- •Физические свойства алкенов
- •Физические свойства некоторых этиленовых углеводородов приведены в табл.3.2
- •Строение алкенов
- •Химические свойства Гетерогенное каталитическое гидрирование
- •Реакции электрофильного присоединения
- •2. Присоединение галогеноводородных кислот (гидрогалогенирование):
- •Реакции радикального присоединения
- •Реакции окисления
- •1. Эпоксидирование (реакция Прилежаева):
- •2. Гидроксилирование (образование гликолей, реакция Вагнера):
- •Реакции по -углеродному атому
- •Полимеризация
- •Отдельные представители
- •Гомологический ряд диенов
- •Синтез изопрена
- •Синтез хлоропрена:
- •Лекция №6. Строение и химические свойства диенов
- •Строение и свойства алленов
- •1. Галогенирование:
- •2. Гидрогалогенирование:
- •3. Гидратация:
- •Строение сопряженных диенов
- •Химические свойства сопряженных диенов
- •5. Окисление:
- •Димеризация
- •Полимеризация
- •Гомологический ряд
- •Изомерия
- •Промышленные способы получения ацетилена
- •Из карбида кальция
- •Пиролиз метана.
- •Лабораторные способы получения ацетилена и его гомологов
- •1. Реакция дегидрогалогенирования:
- •Физические свойства
- •Строение алкинов
- •Химические свойства
- •Реакции присоединения
- •Присоединение воды к алкинам.
- •Отдельные представители
- •Строение бензола
- •Изомерия
- •Номенклатура
- •Методы получения
- •Промышленные источники
- •2. Нефть.
- •3. Из алкинов (Реппе, Зелинский):
- •Лабораторные способы
- •Лекция №10. Химические свойства арОматических углеводородов
- •Механизм реакций электрофильного замещения
- •Реакции электрофильного замещения
- •1. Нитрование:
- •2. Галогенирование:
- •3. Сульфирование. Для сульфирования часто применяется серная кислота, содержащая избыток so3 (олеум). Кислотно-основное равновесие между двумя молекулами серной кислоты:
- •Реакции окисления
- •3. Озонолиз:
- •4. Каталитическое окисление о2 в присутствии медного катализатора.
- •Влияние заместителей в бензольном ядре на электрофильное замещение
- •Распределение изомеров при нитровании производных бензола
- •Электрофильное замещение в дизамещенных бензолах
- •Отдельные представители
- •Нафталин
- •Изомерия, номенклатура
- •Способы получения
- •Структура нафталина
- •Химические свойства
- •Осторожное окисление нафталина и его гомологов приводит к потере ароматичности с образованием хинонов (в отличие от гомологов бензола):
- •Ориентация электрофильного замещения в нафталине
- •Антрацен и фенантрен
- •Гексафенилэтан
- •Библиографический список Основной
- •Дополнительный
- •Содержание
Промышленные источники алкенов
Олефины в природе встречаются редко. Низшие алкены в небольших количествах могут входить в состав нефтяного газа. В большом количестве олефины образуются при крекинге и пиролизе нефти. Так, например, этилен, пропилен, бутилены содержатся в газах крекинга. Высшие алкены, которые выделить затруднительно, входят в состав бензинов. Алкены-1 с четным числом атомов углерода используют в производстве детергентов и получают ионной полимеризацией по методу Циглера-Натта.
Методы синтеза алкенов
Алкены могут быть получены реакциями отщепления (элиминирования) из различных функциональных производных и гидрирования из ацетиленовых углеводородов.
Получение алкенов отщеплением может быть представлено общей схемой:

Здесь X=Y=H, Hal; X=H, Y=Hal, OH
1. Дегидрирование алканов. Алкены от С2 до С4 получают дегидрированием алканов. Например, при дегидрировании бутана образуются бутены. В качестве катализаторов используют оксиды металлов:
![]()
2. Крекинг (расщепление) алканов приводит к смеси алкенов:
![]()
3. Дегалогенирование вицинальных дигалогенидов:
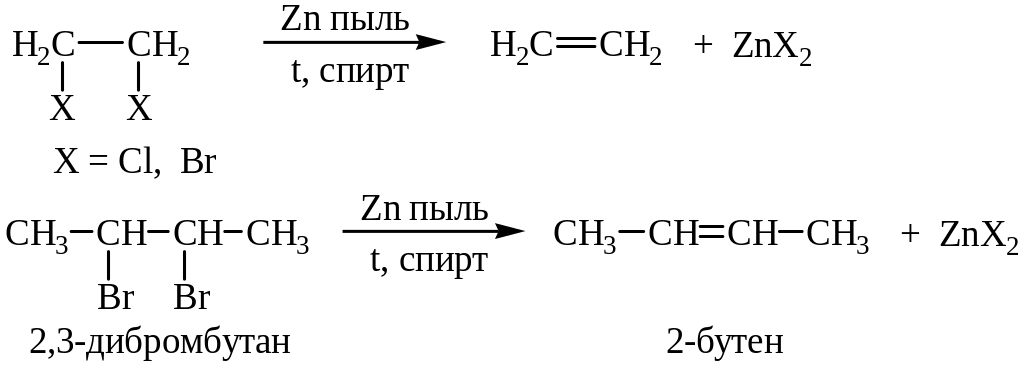
4. Дегидрогалогенирование алкилгалогенидов. В реакции дегидрогалогенирования используют третичные, вторичные и первичные галоидные алкилы. Реакцию проводят в среде этилового спирта в присутствии основания (КОН, NaOH) или при действии третбутилата калия в ДМСО:

Например:
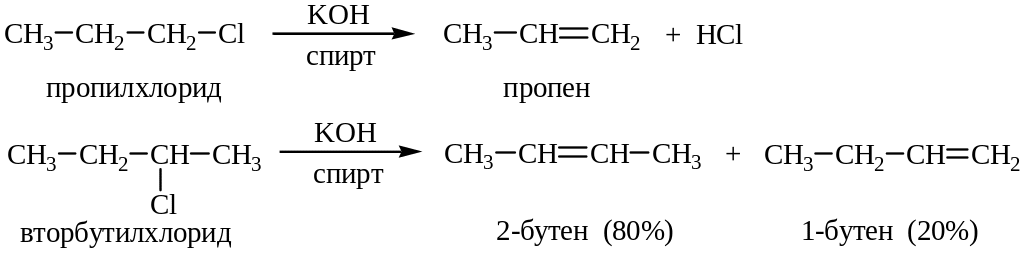
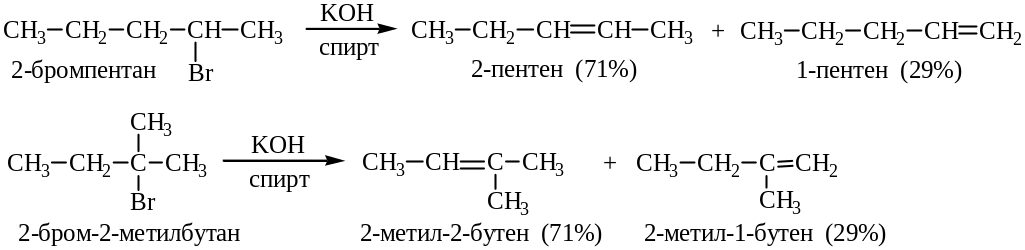
Направление реакции определяется относительными скоростями конкурирующих реакций.

Чем устойчивей алкен, тем легче он образуется в реакции дегидрогалогенирования. Относительная скорость образования алкенов:

Реакционная способность алкилгалогенидов уменьшается в порядке третичный > вторичный > первичный.
Ряд легкости образования алкенов:
R2C=CR2 > R2C=CHR > R2C=CH2 > RHC=CHR > RHC=CH2
Механизм дегидрогалогенирования Е1:
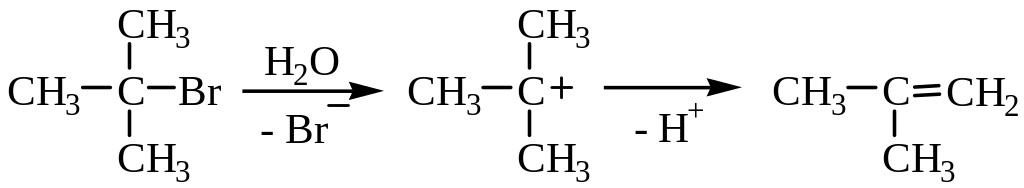
Реакция включает две стадии: первоначально происходит диссоциация связи углерод – галоген с образованием карбкатиона, а затем быстро отщепляется протон, и образуется двойная связь.
Механизм дегидрогалогенирования Е2:

Процесс происходит согласованно, в одну стадию. Галоген отщепляется с парой электронов -связи в виде аниона, а водород отрывается гидроксид-анионом с образованием молекулы воды. Оставленная водородом пара электронов образует -связь.
Откуда берется энергия для разрыва связи С-Н и С-Hal?
За счет образования связи Н-ОН
За счет образования -связи (60 ккал)
За счет энергии сольватации ионов.
Ионные реакции проходят в растворах. Ион водорода вытягивается из молекулы гидроксид-ионом, ион галогена сольватируется молекулами растворителя.
5. Дегидратация спиртов (в присутствии серной или 85%-ной фосфорной кислот):
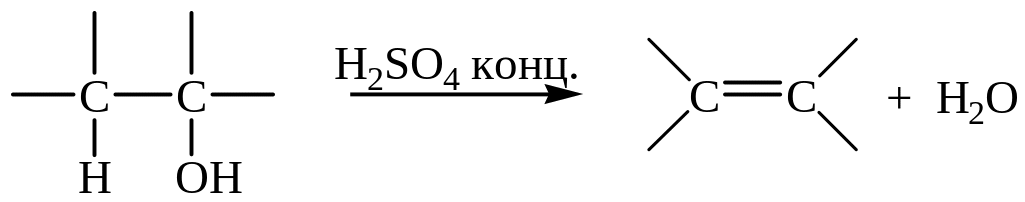
Легкость реакции дегидратации изменяется в ряду третичные вторичные первичные спирты.
Примеры:

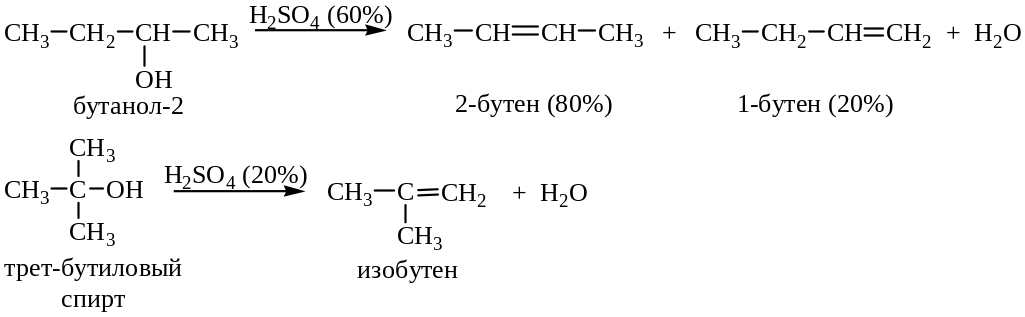
Механизм дегидратации спирта Е1
Кислотно – основное равновесие по Бренстеду – Лоури:
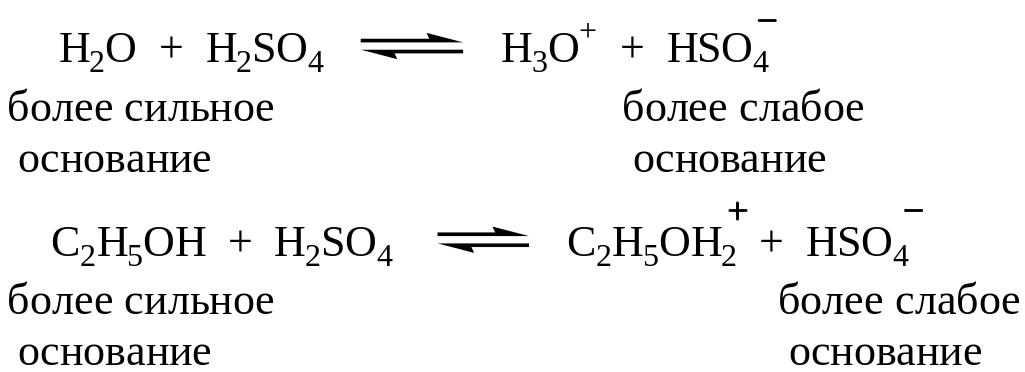

Равновесные реакции сдвигаются в сторону образования алкена при отгонке его из реакционной среды.
Образование карбониевого иона по механизму Е1 происходит в результате отщепления воды от протонированного спирта. Это энергетически более выгодно, чем отрыв гидроксид – аниона от спирта:

Далее происходит отщепление протона. Пара электронов, оставленная водородом, образует -связь между атомами углерода.
Устойчивость карбониевых катионов
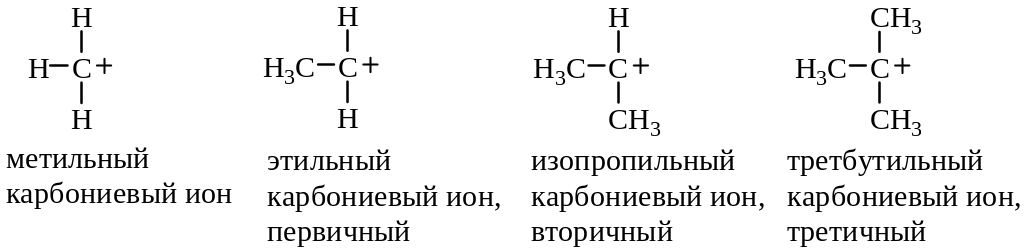
Энергия, необходимая для отрыва электрона от молекулы или атома, называется потенциалом ионизации Н (табл. 3.1).
Таблица 3.1
|
Н – потенциал ионизации (ккал/моль) |
|
Н = 230 |
|
Н = 202 |
|
Н = 182 |
|
Н = 171 |
Сверху вниз в таблице потенциалы ионизации уменьшаются, а устойчивость катионов увеличивается. Устойчивость заряженной системы повышается при распределении заряда.
Алкильные группы по сравнению с водородом имеют тенденцию смещать электронную плотность вдоль связи по направлению к электронодефицитным центрам. Смещая электронную плотность, алкильные группы приобретают небольшой положительный заряд, и, следовательно, заряд, первоначально сконцентрированный на одном атоме, оказывается распределенным по молекуле. Таким образом, увеличение числа алкильных заместителей у катионного центра стабилизирует катион:
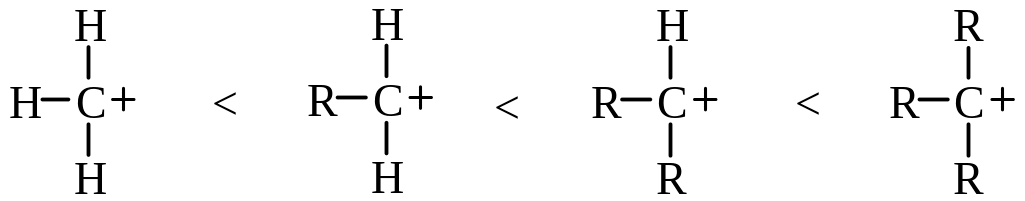
Один и тот же элемент может обладать различными индуктивными эффектами в зависимости от его состояния гибридизации. По сравнению с Н или С-sp3 – заместителями индуктивные эффекты С – sp2 и С – sp дестабилизируют карбкатион:
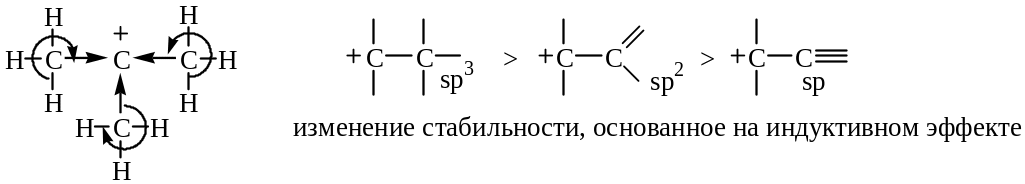
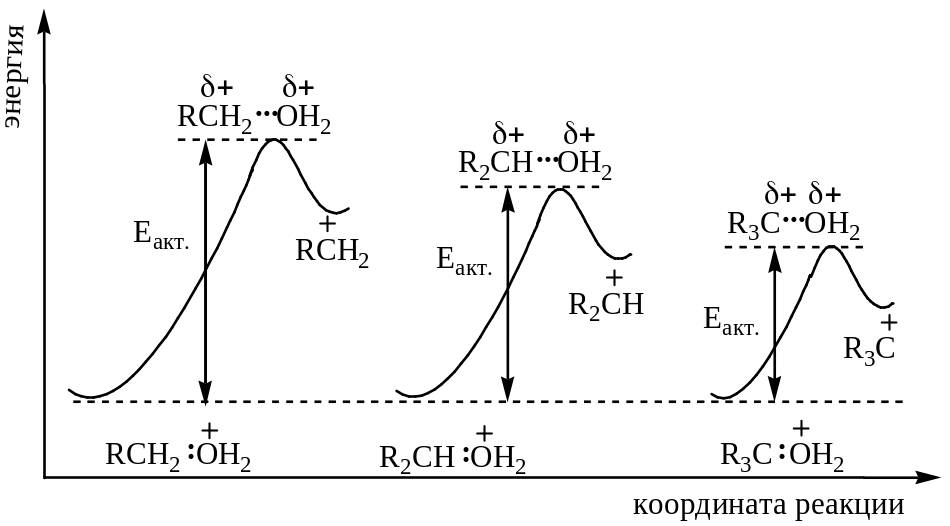
Устойчивость карбониевого иона зависит, главным образом, от электронодонорного или электроноакцепторного характера заместителей. Чем устойчивей карбониевый ион, тем легче он образуется. Рассмотрим переходное состояние при образовании карбониевого иона:
![]()
В переходном состоянии атомы углерода и кислорода имеют частичные положительные заряды (+). Группы, подающие электроны, стремятся погасить частичный положительный заряд, имеющийся на атоме углерода, и тем самым стабилизируют переходное состояние. Стабилизация переходного состояния понижает энергию активации и вследствие этого ускоряет реакцию.
Таким образом, тот же самый фактор подачи электронов, который стабилизирует ион карбония, также стабилизирует переходное состояние при образовании карбониевого иона. Более устойчивый ион карбония образуется быстрее:
Перегруппировка ионов карбония:
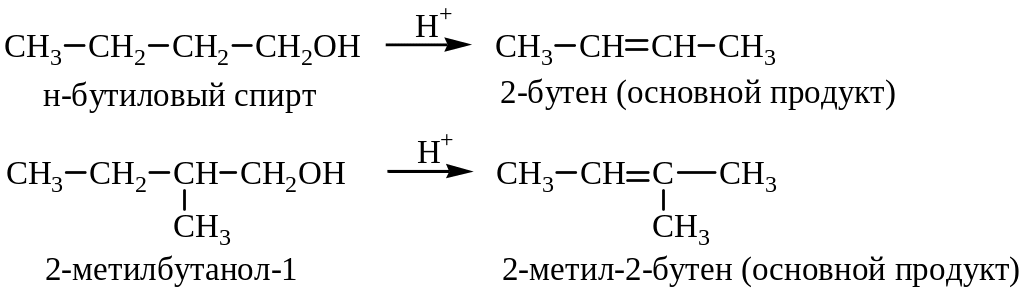

Ион карбония может отщеплять протон с образованием алкена, а также перегруппировываться в более устойчивый карбкатион.
Изомерный состав продуктов в реакциях дегидрогалогенирования и дегидратации находится в соответствии с правилом Зайцева: протон отщепляется от углерода с наименьшим числом водородных атомов, т.е. вторичные или третичные галоиды и спирты при отщеплении образуют олефины с наибольшим числом алкильных групп при кратной связи.
Правило Зайцева объясняет существование наиболее замещенного, термодинамически более устойчивого алкена.
Дегидрогалогенирование алкилгалогенидов и дегидратация спиртов - важнейшие реакции получения алкенов.
6. Восстановление алкинов. Выбор метода восстановления позволяет получить либо цис-, либо транс-изомеры. Так, например, использование катализаторов Линдлара (Pb, PbO и CaCO3) позволяет получить цис-изомер:
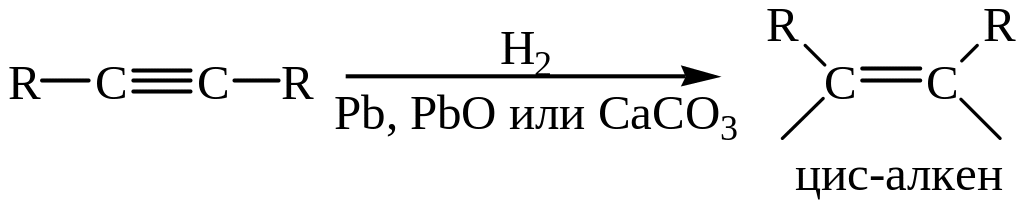
Восстановление натрием или литием в жидком аммиаке или этиламине приводит к транс алкенам:


