
- •Н.В. Стулин, м.Н. Земцова, и.К. Моисеев
- •Углеводороды
- •Текст лекций по органической химии
- •Самара 2004
- •Гомологический ряд
- •Изомерия
- •Номенклатура
- •Рациональная номенклатура
- •Систематическая номенклатура (iupac)
- •Способы получения алканов
- •Промышленные методы
- •1. Метод Бергиуса (гидрогенизация бурых углей):
- •2. Метод Фишера-Тропша:
- •Лабораторные методы
- •3. Декарбоксилирование солей карбоновых кислот:
- •4. Гидрирование алкенов:
- •5. Восстановление галоидных алкилов:
- •Физические свойства алканов
- •Строение алканов
- •Химические свойства алканов
- •Реакции замещения
- •Общие проблемы галогенирования алканов
- •Реакции окисления
- •Мягкое окисление
- •Реакция расщепления (крекинг и пиролиз)
- •Отдельные представители
- •Лекция №3. Алкены
- •Гомологический ряд. Изомерия
- •Номенклатура
- •Промышленные источники алкенов
- •Методы синтеза алкенов
- •3. Дегалогенирование вицинальных дигалогенидов:
- •Физические свойства алкенов
- •Физические свойства некоторых этиленовых углеводородов приведены в табл.3.2
- •Строение алкенов
- •Химические свойства Гетерогенное каталитическое гидрирование
- •Реакции электрофильного присоединения
- •2. Присоединение галогеноводородных кислот (гидрогалогенирование):
- •Реакции радикального присоединения
- •Реакции окисления
- •1. Эпоксидирование (реакция Прилежаева):
- •2. Гидроксилирование (образование гликолей, реакция Вагнера):
- •Реакции по -углеродному атому
- •Полимеризация
- •Отдельные представители
- •Гомологический ряд диенов
- •Синтез изопрена
- •Синтез хлоропрена:
- •Лекция №6. Строение и химические свойства диенов
- •Строение и свойства алленов
- •1. Галогенирование:
- •2. Гидрогалогенирование:
- •3. Гидратация:
- •Строение сопряженных диенов
- •Химические свойства сопряженных диенов
- •5. Окисление:
- •Димеризация
- •Полимеризация
- •Гомологический ряд
- •Изомерия
- •Промышленные способы получения ацетилена
- •Из карбида кальция
- •Пиролиз метана.
- •Лабораторные способы получения ацетилена и его гомологов
- •1. Реакция дегидрогалогенирования:
- •Физические свойства
- •Строение алкинов
- •Химические свойства
- •Реакции присоединения
- •Присоединение воды к алкинам.
- •Отдельные представители
- •Строение бензола
- •Изомерия
- •Номенклатура
- •Методы получения
- •Промышленные источники
- •2. Нефть.
- •3. Из алкинов (Реппе, Зелинский):
- •Лабораторные способы
- •Лекция №10. Химические свойства арОматических углеводородов
- •Механизм реакций электрофильного замещения
- •Реакции электрофильного замещения
- •1. Нитрование:
- •2. Галогенирование:
- •3. Сульфирование. Для сульфирования часто применяется серная кислота, содержащая избыток so3 (олеум). Кислотно-основное равновесие между двумя молекулами серной кислоты:
- •Реакции окисления
- •3. Озонолиз:
- •4. Каталитическое окисление о2 в присутствии медного катализатора.
- •Влияние заместителей в бензольном ядре на электрофильное замещение
- •Распределение изомеров при нитровании производных бензола
- •Электрофильное замещение в дизамещенных бензолах
- •Отдельные представители
- •Нафталин
- •Изомерия, номенклатура
- •Способы получения
- •Структура нафталина
- •Химические свойства
- •Осторожное окисление нафталина и его гомологов приводит к потере ароматичности с образованием хинонов (в отличие от гомологов бензола):
- •Ориентация электрофильного замещения в нафталине
- •Антрацен и фенантрен
- •Гексафенилэтан
- •Библиографический список Основной
- •Дополнительный
- •Содержание
Осторожное окисление нафталина и его гомологов приводит к потере ароматичности с образованием хинонов (в отличие от гомологов бензола):

Ориентация электрофильного замещения в нафталине
Как и в случае ряда бензола, заместители в нафталиновом кольце оказывают влияние на вступление электрофильной частицы. Кроме того, оказывает влияние и различная реакционная способность α - и β - положений нафталинового кольца.
1. Электронодонорный заместитель в α - положении ориентирует новый заместитель в то же кольцо в положение 4:

2. Если такой заместитель находится в β - положении, то ориентация происходит в орто - положение (α):

Если в одном из колец находится электроноакцепторный заместитель, то такое кольцо дезактивируется к электрофильному замещению и новая электрофильная частица вступает во второе кольцо:

Антрацен и фенантрен
Источником получения антрацена является каменноугольная смола:
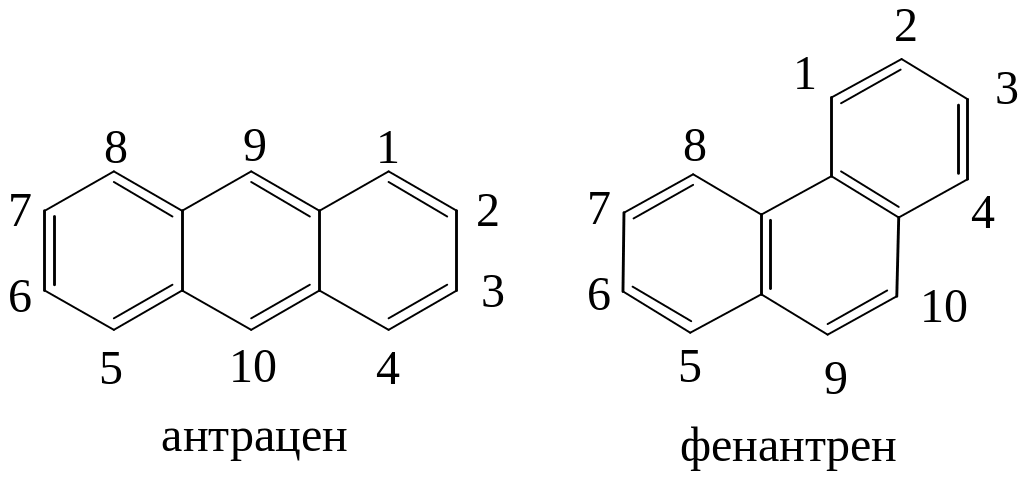
По своим свойствам относятся к ароматическим соединениям. Молекулы плоские. Характерна еще большая непредельность, чем для нафталина. Наиболее активными являются положения 9, 10. Легко присоединяют Н2, Br2, малеиновый ангидрид по этим положениям. Антрацен и фенантрен еще менее устойчивы к реакциям окисления и восстановления, чем нафталин. Окисляются до 9, 10 хинонов, восстанавливаются до 9,10-дигидропроизводных.
Оба соединения легко вступают в реакции электрофильного замещения, чаще с образованием смеси изомеров или полизамещенных. Производные, за немногим исключением, получают иным путем. Бромирование проходит в положение 9 (обычно реакция сопровождается присоединением).
Антрацен используется для синтеза антрахинона. Наиболее важным из производных антрацена являются антрахиноны, являющиеся красителями. Сам антрахинон может быть получен при окислении антрацена
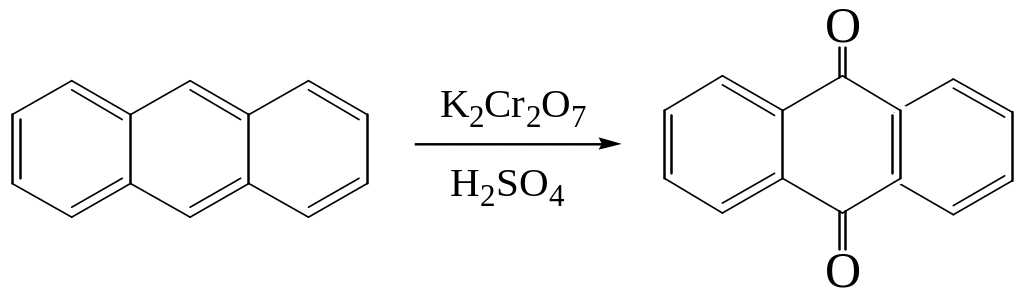
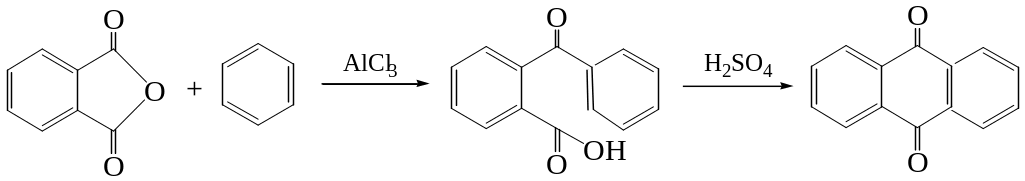
или циклизацией
Фенантрен, так же, как и антрацен, легко присоединяет в положение 9,10. Эти же положения более активны для электрофильной атаки и легче подвергаются воздействию кислорода:
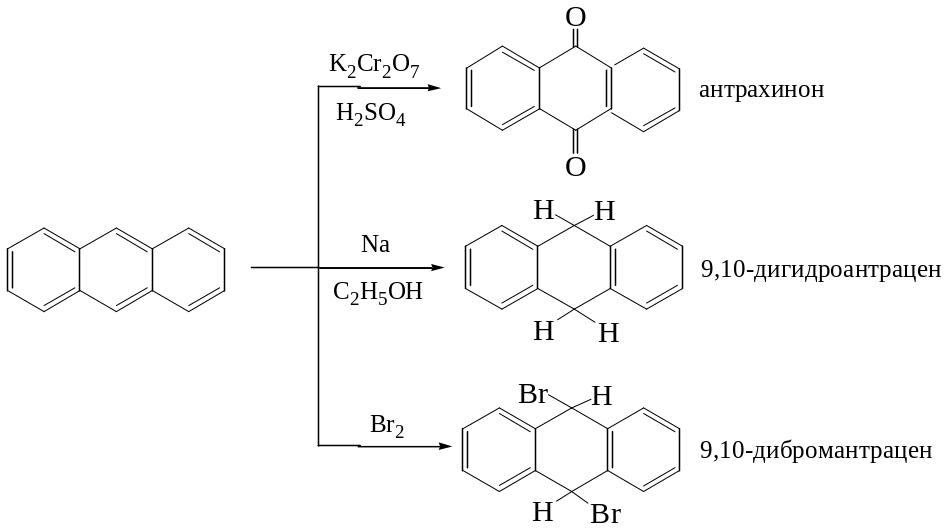
Аналогично протекают реакции для фенантрена.
Реакция электрофильного замещения протекает в положение 9,10, по обычному двухстадийному механизму, но, как правило, сопровождается реакциями присоединения.

Стабилизация карбониевого иона возможна как за счет отщепления протона, так и за счет присоединения нуклеофильной частицы.
Сам фенантрен применения не нашел, однако производные его, содержащие полностью или частично гидрированный скелет фенантрена, широко распространены в животном и растительном мире (стероиды, алкалоиды, гормоны).
По мере увеличения числа циклов уменьшается устойчивость к реакциям присоединения, снижается ароматичность.
Многоядерные арены привлекают внимание тем, что могут стать сырьем для анилинокрасочной промышленности и др.
Вместе с тем некоторые из них обладают канцерогенным действием и усиленно изучаются в связи с проблемой возникновения и профилактики рака.
Гексафенилэтан
В 1900 Гомберг предположил, что при действии металлов (Zn,Cu,Hg,Ag) на трифенилхлорметан образуется ГФЭ. Однако в настоящее время установлено, что полученный углеводород имеет структуру 1-(дифенилметилен)-4-трифенил-2,5-циклогексадиена.

В растворах это соединение частично диссоциирует на свободные радикалы, что приводит к изменению бесцветной окраски на желтую.
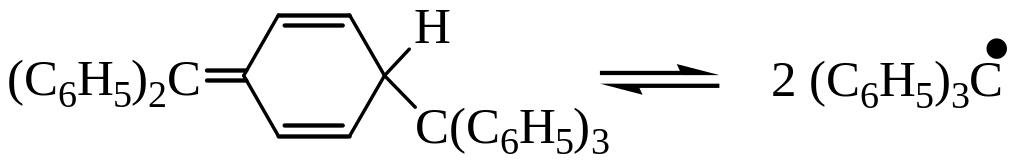
Впервые существование устойчивого трифенилметильного радикала было обнаружено Гомбергом при решении задачи синтеза ГФЭ по реакции Вюрца. Наличие свободных радикалов в растворе установлено по парамагнитным свойствам этих частиц, где нескомпенсированный спин электрона создает магнитное поле вокруг свободного радикала.
Фактически с арилгалогенидом и Na взаимодействует не ГФЭ, а именно радикал трифенилметил. Для диссоциации СН3-СН3 требуется 85 ккал/моль, а для (СбН5)3С-С(С6Н5)3 необходимо всего 12 ккал/моль. Причина понижения энергетического уровня связана с высокой устойчивостью (С6H5)3С, которая вызвана тем, что неспаренный электрон не концентрируется на атоме углерода, а рассредоточен по всем бензольным ядрам благодаря сопряжению. Эта причина устойчивости радикала - главная. Однако есть и вторая - рекомбинации радикалов препятствуют пространственные затруднения.
