
- •1. Теплопровідність речовин
- •1.1. Коефіцієнт теплопровідності речовин.
- •1.2. Температурне поле. Закон Фур’є.
- •1.3. Диференційне рівняння теплопровідності для нерухомого середовища.
- •1.4. Окремі випадки диференціальних рівнянь теплопровідності. Класифікація задач теплопроводності.
- •1.5 Умови однозначності
- •Методи вимірювання коєфіцієнту Теплопровідності
- •2.4 Метод циліндричних шарів. 19
- •2.6 Метод Кольрауша. 25
- •2.7 Вимірювання коефіцієнта теплопровідності газів 27
- •Розділ 1 теплопровідність речовин
- •1.1. Коефіцієнт теплопровідності речовин.
- •Розділ 2 Методи вимірювання коефіцієнту теплопровідності
- •2.1. Вимірювання коефіцієнта теплопровідності твердих тіл методом плоского шару.
- •2.3. Відносні методи визначення коефіцієнта теплопровідності. Метод Хрістіансена. Метод циліндрів.
- •2.4. Метод циліндричних шарів.
- •2.5. Визначення коефіцієнта теплопровідності металевого стержня (Метод Бората-Вінера)
- •2.6. Метод Кольрауша.
- •2.7. Вимірювання коефіцієнта теплопровідності газів
- •Розділ 3 експериментальне визначення коефіцієнту теплопровідності металів
- •3.1. Визначення коефіцієнта теплопровідності платини.
- •3.2. Врахування теплообміну з навколишнім середовищем.
- •Коефіцієнта теплопровідності вольфраму.
- •Методи вимірювання теплоємності
- •Теплоємність газів, рідин і твердих тіл.
- •Вимірювання теплоємності
- •Визначення водяного еквівалента калориметра
- •Визначення водяного еквівалента термометра
- •Метод змішування
- •Метод електричного калориметра
- •Відносний метод
- •Метод охолодження
- •Метод випромінювання
- •Метод постійної течії (неперервного витікання рідини)
- •Метод термічного аналізу
- •Визначення співвідношень питомих теплоємкостей газу методом Клемана – Дезорма
- •До методів визначення коефіцієнту температуропровідності
- •4.5. Охолодження (нагрів) циліндра і кулі
- •4.7 Регулярний тепловий режим
- •1.8. Періодичний нестаціонарний процес теплопровідності
- •Література
Вимірювання теплоємності
Оскільки теплоємність визначається співвідношенням

то
важливо забезпечити точність вимірювання
T.
Сучасні
методи
дають змогу легко вимірювати невелику
різницю температур з точністю до 0,001 ,
що цілком достатньо. При вимірюванні
,
що цілком достатньо. При вимірюванні
 досягнути точності важко внаслідок
втрат або підведення не врахованого
тепла. Видозмінюючи калориметричні
методи вимірювання
,
можна зменшувати похибку. Існує велика
кількість калориметрів, які відрізняються
за своєю будовою і принципом дій.
Розглянемо схему одного з калориметрів,
які часто використовуваються при
вимірюванні теплоємності (переважно
при низьких температурах).
досягнути точності важко внаслідок
втрат або підведення не врахованого
тепла. Видозмінюючи калориметричні
методи вимірювання
,
можна зменшувати похибку. Існує велика
кількість калориметрів, які відрізняються
за своєю будовою і принципом дій.
Розглянемо схему одного з калориметрів,
які часто використовуваються при
вимірюванні теплоємності (переважно
при низьких температурах).
Калориметр
(рис.2) – це зразок з досліджуваної
речовини А,
оточений
оболонкою В,
на
який намотано електричний нaгpiвник
R,
що
є водночас термометром опору, який
контактує
зі зразком.
Роль оболонки зводиться до
теплової
ізоляції
від
навколишнього
середовища шляхом розрідження до
високого
вакууму
об'єму
С.
Підвіска
зразка на
металевих
нитках Д,
які
служать також струмовводами, не повинна
порушувати цієї ізоляції. У такому
ідеальному калориметрі вимірювання
зводиться
до
простих операцій.
Не створюючи вакууму
всередині
калориметра,
зразок поміщають
у термостат (електрична піч, посудина
з рідиною, яка має
постійну температуру тощо), доводять
до заданої температури
i вакуумізують його. Потім через нагрівник
протягом певного часу
(точно виміряного) пропускають електричний
струм, вимірюючи
при цьому різницю потенціалів на його
кінцях i силу струму в
ньому. Визначивши підвищення температури,
можна обчислити теплоємність
зразка.
Оболонка не забезпечує повної теплової
ізоляції калориметра, внаслідок чого
відбувається теплообмін через підвідні
провідники Д
i
термопари Е.
У
зв'язку з цим при вимірюванні теплоємностi
ще до вмикання струму знімають криву
залежності температури
Т
калориметра
від часу
 .
На кривій (рис.3) цьому відповідає
ділянка АВ.
У певний
момент часу
.
На кривій (рис.3) цьому відповідає
ділянка АВ.
У певний
момент часу
 вмикають нагрівник, не
припиняючи спостереження за зміною
температури Т
з
часом
.
Після
цього температура калориметра
змінюватиметься швидше.
Цьому періоду в
вмикають нагрівник, не
припиняючи спостереження за зміною
температури Т
з
часом
.
Після
цього температура калориметра
змінюватиметься швидше.
Цьому періоду в ідповідає
ділянка ВС.
Через
час
після вимкнення температура
калориметра почне знижуватися (ділянка
СД).
ідповідає
ділянка ВС.
Через
час
після вимкнення температура
калориметра почне знижуватися (ділянка
СД).
Користуючись
даною кривою, можна обчислити дійсне
значення
зміни температури
 ,
спричинене підведенням тепла до
калориметра.
Для цього прямі АВ
i
СД
продовжують
(див. рис.3) штриховою лінією i з'єднують
їx вертикальною прямою, що проходить
через точку ділянки ВС,
яка
відповідає половині виміряної різниці
температур у період між умиканням i
вимиканням нarpiвника.
Довжина цієї
вертикальної
прямої EF
i
є дійсним значенням
T.
,
спричинене підведенням тепла до
калориметра.
Для цього прямі АВ
i
СД
продовжують
(див. рис.3) штриховою лінією i з'єднують
їx вертикальною прямою, що проходить
через точку ділянки ВС,
яка
відповідає половині виміряної різниці
температур у період між умиканням i
вимиканням нarpiвника.
Довжина цієї
вертикальної
прямої EF
i
є дійсним значенням
T.
Hapeштi, можна включити диференціальну термопару, один контакт якої розміщений на зразку, другий – у зовшшньому середовищі. Показання її відповідатимуть різниці температур за умови якісного градуювання термопар.
Визначення водяного еквівалента калориметра

Під водяним еквівалентом К будь-якого тіла розуміють кількість теплової енергії, необхідну для нагрівання його на 1°С, яка чисельно дорівнює мaci води, для нагрівання якої на 1 °С потрібна така ж кількість теплової енергії, як i для нагрівання тіла.
Водяний
еквівалент будь-якого однорідного
тіла дорівнює добутку його маси на
питому
теплоємність
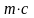 ,
тобто
теплоємності даного
тіла. Для системи тіл
водяний
еквівалент визначається як
,
тобто
теплоємності даного
тіла. Для системи тіл
водяний
еквівалент визначається як

Якщо К калориметра, мішалки i термометра незначні порівняно з кількістю теплоти Q,, яка витрачається на протікання досліджуваних процесів, i вимірювання теплових сталих цих процесів не забезпечують достатньої точності результатів, то їх не визначають i не беруть до уваги при остаточних підрахунках. В іншиx випадках водяні еквіваленти обчислюють або знаходять дослідним шляхом (калориметричним методом).
Методи калориметрії застосовуються у багатьох галузях науки i техніки, тому icнyє чимало конструкцій кaлopимeтpiв. Найпростіший, так званий калориметр змішування (рис.4), складається з металевої посудини циліндричної форми 1, яка для запобігання контакту з зовнішнім середовищем розміщена на теплоізоляційній підставці 5 у посудині 2 більших poзмipiв. Для вирівнювання температури рідини (води) по всьому об'єму користуються мішалкою 3. Термометром 4 вимірюють температуру рідини на початку i в кінці процесу теплообміну.
При грубих вимірюваннях можна вважати, що рідина, калориметр i його допоміжні частини за час досліду не встигнуть віддати помітну кількість теплоти зовнішньому середовищу. При точних калориметричних вимірюваннях необхідно вносити відповідні поправки.
Нехай
калориметрична установка складається
з простого калориметра
та мішалки масою відповідно
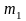 і
і
 та питомою теплоємністю
та питомою теплоємністю
 і
і
 .
Тоді
водяний еквівалент калориметра з
мешалкою
.
Тоді
водяний еквівалент калориметра з
мешалкою
K = m1c1 + m2c2. (20)
Отже,
водяний еквівалент легко знайти, якщо
відомий матеріал, з
якого виготовлені калориметр i мішалка,
а також можна визначити
їx масу. Інакше (при застосуванні
електрокалориметрів) водяний
еквівалент визначають експериментально.
Для цього знаходять
масу
 внутршньої посудини калориметра з усіма
її допоміжними
частинами, зважуючи на технічних терезах.
Наповнюють
внутрішню посудину до половини водою
кімнатної температури
i знову зважують. Нехай її маса з водою
.
Тоді
різниця
внутршньої посудини калориметра з усіма
її допоміжними
частинами, зважуючи на технічних терезах.
Наповнюють
внутрішню посудину до половини водою
кімнатної температури
i знову зважують. Нехай її маса з водою
.
Тоді
різниця
 дає
масу води, налитої в калориметр m.
дає
масу води, налитої в калориметр m.
Помістивши
внутрішню посудину калориметра у
зовнішню, занурюють
у воду термометр i вимірюють її температуру
 .
Визначають
температуру гарячої води
.
Визначають
температуру гарячої води
 i
наливають у калориметр з холодною водою
таку її кількість, яка приблизно дорівнює
половині кількості холодної води. Після
цього воду перемішують до появи
в калориметрі стану термодинамічної
рівноваги та вимірюють кінцеву температуру
cyміші Q.
Знову
зважують внутрішню посудину
калориметра. Нехай тепер її маса т2.
Різниця
i
наливають у калориметр з холодною водою
таку її кількість, яка приблизно дорівнює
половині кількості холодної води. Після
цього воду перемішують до появи
в калориметрі стану термодинамічної
рівноваги та вимірюють кінцеву температуру
cyміші Q.
Знову
зважують внутрішню посудину
калориметра. Нехай тепер її маса т2.
Різниця
 –
це
маса долитої в калориметр гарячої води
–
це
маса долитої в калориметр гарячої води
 .
.
На підставі проведених дослідів складають рівняння теплового балансу для даного процесу:
т3
с (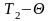 )
= (тс
+ ткск)
(
)
= (тс
+ ткск)
( )
(21)
)
(21)
за
яким визначають водяний еквівалент
калориметра

 (22)
(22)
