
- •Общие указания
- •1. Порядок подготовки и выполнения лабораторных работ
- •2. Правила по технике безопасности при выполнении лабораторных работ
- •3. Измерительные приборы
- •4. Обработка результатов измерений
- •4.1 Измерение физических величин
- •4.2. Гистограмма и ее построение
- •4.3 Нормальное распределение и его характеристики
- •4.5. Порядок расчета погрешностей прямых измерений
- •4.6. Построение и оформление графиков
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа №102 изучение движения тел по наклонной плоскости
- •Теория метода и описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа № 103 определение момента инерции махового колеса и силы трения в опоре
- •Теория метода и описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа № 104 проверка основного закона динамики вращательного движения на маятнике обербека
- •Теоретические сведения
- •Теория метода и описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Теоретические сведения
- •Теория метода и описание установки
- •Порядок выполнения работы
- •Контрольные вопросы
- •Лабораторная работа № 202 определение коэффициента вязкости жидкости методом стокса
- •Краткие теоретические сведения
- •Описание прибора и метода Стокса
- •Порядок выполнения работы
- •Контрольные вопросы
Теоретические сведения
Для выполнения лабораторной работы необходимо знать:
1. Первое начало термодинамики утверждает, что количество теплоты, переданное газу, идет на смену его внутренней энергии и на осуществление работы газом против внешних сил
Q = dU + W, (1)
где Q - количество теплоты, Дж;
dU - изменение внутренней энергии, Дж;
W - работа против внешних сил, Дж.
Работа в термодинамике определяется как
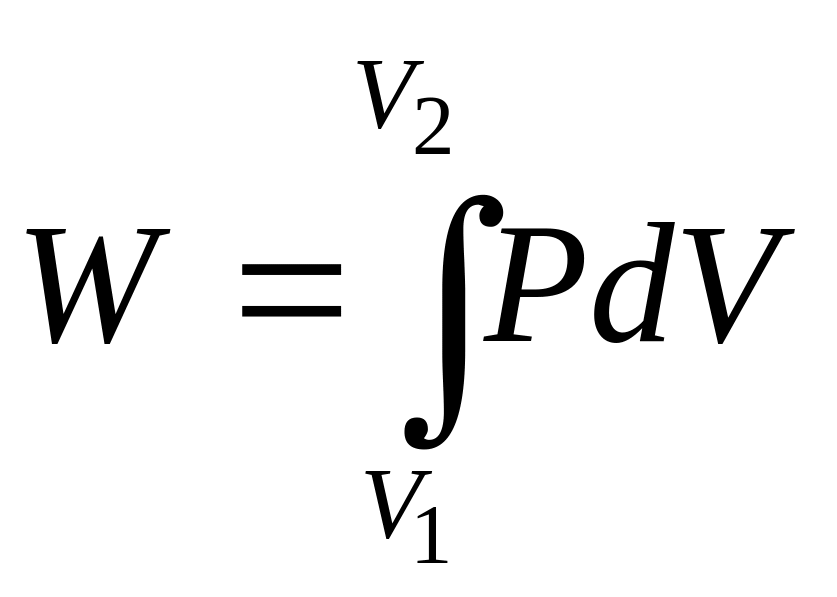 ,
(2)
,
(2)
где Р - давление газа, Па;
dV - изменение объема системы, м3.
2. Число независимых координат, которые полностью определяют положение точки в пространстве, или количество независимых движений, которые может выполнять точка, называется числом степеней свободы.
Молекуле одноатомного газа приписывают три степени свободы поступательного движения. Система, которая состоит из двух атомов, имеет пять степеней свободы, три из них поступательные, а две - вращательные. Трехатомная молекула имеет шесть степеней свободы, из них три поступательные, и три вращательные степени свободы.
3. Закон
о равномерном распределении кинетической
энергии
утверждает, что на каждую поступательную
и вращательную степень свободы молекулы
приходится
в среднем одинаковая кинетическая
энергия, которая равняется
![]() .
Итак,
средняя кинетическая энергия молекулы
определяется выражением
.
Итак,
средняя кинетическая энергия молекулы
определяется выражением
![]() ,
(3)
,
(3)
где Т - термодинамическая температура, К;
i- число степеней свободы;
k -
постоянная Больцмана,
![]() .
.
4. Внутренняя энергия Um одного моля идеального газа соответственно равняется
![]() (4)
(4)
где Na
- число
Авогадро,
![]() ;
;
R
= kNa
= 8,31![]() - универсальная
газовая постоянная
- универсальная
газовая постоянная
5. Теплоемкостью С тела называется физическая величина, которая численно равняется отношению количества теплоты Q, которое получает тело, к изменению его температуры dТ в данном термодинамическом процессе:
![]() (5)
(5)
Величина С зависит от массы тела, его химического состава, и процесса, в котором сообщается теплота Q.
Теплоемкость единицы массы вещества называют удельной теплоемкостью с – величина, которая равняется количеству теплоты, необходимому для нагревания 1 кг вещества на 1 К:
![]() (6)
(6)
где т – масса газа, кг.
Удельная теплоемкость измеряется в Дж/(кг(К).
Молярной теплоемкостью Сm называется теплоемкость одного моля вещества, т.е. величина, которая равняется количеству теплоты, необходимому для нагревания 1 моля вещества на 1 К:
![]() ,
(7)
,
(7)
где v - число молей (количество вещества).
Молярная теплоемкость измеряется в Дж/(моль(К).
Эти теплоемкости связанные между собой соотношением:
![]() (8)
(8)
где М – молярная масса вещества.
6.Тепоремкость газа зависит от вида изопроцесса, т.е. от условий. при которых протекает нагревание газа.
Если нагревать газ при постоянном объеме (изохорный процесс), то все тепло, которое получает газ извне, полностью идет на увеличение внутренней энергии. В этом случае W = 0, и первое начало термодинамики имеет вид:
QV = dU. (9)
Тогда молярная теплоемкость при постоянном объеме
![]() (10)
(10)
Подставим в формулу (10) выражение (4) для внутренней энергии одного моля идеального газа и получим выражение для молярной теплоемкости газа при постоянном объеме:
 .
(11)
.
(11)
Если нагревать газ при постоянном давлении (изобарный процесс), то поглощенное тепло идет не только на увеличение внутренней энергии, но и на работу изобарического расширения. Поэтому теплоемкость Cр при постоянном давлении должна быть больше, чем теплоемкость СV при постоянном объеме. Особенно эти теплоемкости различаются у газов вследствие относительно большого коэффициента объемного расширения.
Для изобарического процесса первое начало термодинамики имеет вид:
Q = dU + W , (12)
где W = PdV.
Тогда, по определению
![]() (13)
(13)
Из уравнения Менделеева-Клапейрона для одного моля выразим величину: PdVт:
PdVт = RdT (14)
Подставив у уравнение (13) выражение (4) и (14), получим выражение для молярной теплоемкости при постоянном давлении:
![]() (15)
(15)
Молярные теплоемкости СVт и Cpт связанны уравнением Майера:
СРm – СVm = R (16)
Суть этого уравнения заключается в том, что при изобарическом нагревании газа на один градус к газу должно быть подведено больше тепла, чем для такого же изохорического нагревания. Уравнение Майера раскрывает физический смысл универсальной газовой постоянной R: она равняется работе, которую совершает 1 моль идеального газа при изобарическом расширении.
Отношение теплоемкостей
![]() (17)
(17)
есть величина постоянная для данного газа и принадлежит к числу очень важных термодинамических характеристик.
