
- •Гетерогенность и дисперсность
- •Классификация по размерам частиц дисперсной фазы
- •Поверхностное натяжение
- •Метод избыточных величин Гиббса. Вывод уравнения для свободной энергии системы.
- •Уравнение Гиббса для плоского поверхностного слоя
- •Понятие об адсорбции. Причины адсорбции. Количественные характеристики адсорбции.
- •Вывод адсорбционного уравнения Гиббса для разбавленных растворов и его анализ.
- •Поверхностная активность по Ребиндеру. Графическое определение поверхностной активности.
- •Влияние пав на адсорбцию. Правило Траубе, аналитическое выражение и физическое обоснование
- •Диаграммы состояния поверхностных пленок.
- •Уравнение состояния двумерного газа. Уравнение Фрумкина для реального газа.
- •Классификация пав по химическому строению
- •Мицеллообразование. Строение мицелл.
- •Ккм. Определение ккм. Влияние различных факторов на ккм.
- •Влияние температуры на растворимость ионогенных пав. Диаграмма состояния системы. Точка крафта.
- •Влияние температуры на растворимость неионогенных пав. Диаграмма состояния системы. Точка помутнения и точка высаливания.
- •Теория мономолекулярной адсорбции Ленгмюра. Анализ уравнения Ленгмюра
- •Линейная форма уравнения Ленгмюра. Нахождение константы уравнения графическим методом. Определение удельной поверхности адсорбента.
- •Адсорбция как обратимый экзотермический процесс. Интегральная и дифференциальная теплота адсорбции. Изобара адсорбции.
- •Сравнительная характеристика физической адсорбции и хемосорбции.
- •Природа адсорбционных сил. Уравнение Леннард-Джонса.
- •Смачивание. Краевой угол и теплота смачивания. Уравнение Юнга. Влияние пав на смачивание.
- •Когезия и адгезия. Характер разрушения адгезионного соединения. Условие разрушения адгезионного соединения. Уравнение Дюпре для работы адгезии.
- •Методы диспергирования. Уравнение Ребиндера для работы измельчения
- •Эффект Ребиндера и его роль в диспергировании.
- •Конденсационное образование лиофобных дисперсных систем. Уравнение для радиуса и работы образования критического зародыша
- •Химические и физические методы создания метастабильности в системе. Зависимость размера частиц от различных факторов
- •Гетерогенная конденсация
- •Принцип построения мицелл ионостабилизированных золей. Пример
- •Пептизация
- •Получение лиофильных коллоидных систем
-
Конденсационное образование лиофобных дисперсных систем. Уравнение для радиуса и работы образования критического зародыша
При образовании дисперсных систем под конденсацией понимают возникновение новой фазы путем соединения молекул, ионов или атомов в гомогенной среде.
Образование систем высокой дисперсности по конденсационному механизму возможно, если, с одной стороны, возникает большое число зародышей новой, термодинамически более стабильной фазы, с другой стороны, скорость роста этих зародышей лежит в области определенных умеренных значений.
Факторы, приводящие к появлению новой фазы, можно разделить на две группы: химические, т.е. протекание химических реакций, приводящие к возникновению высоких концентраций слаборастворимого соединения и физические такие как изменения давления, температуры.
-
Химические и физические методы создания метастабильности в системе. Зависимость размера частиц от различных факторов
Химические: протекание химических реакций приводит к возникновению высоких концентраций слаборастворимых соединений. Физические: изменение давления и температуры, замена растворителя.
-
Реакция обмена. Этим способом получают золи галогенидов, сульфидов и гидроксидов металлов. Характерным примером синтеза золей с использованием реакции обмена является получение гидрозолей иодида серебра.
-
Реакции восстановления. Получение золей золота и серебра при взаимодействии солей этих металлов с различными восстановителями: фосфором (Фарадей), таннитом (Оствальд), формальдегидом (Зигмогди), ацетоном (Девис), например
-
Реакция окисления
-
Гидролиз солей. Гидролиза хлорного железа
-
Конденсация паров. Сущность метода заключается в том, что в газообразной системе при изменении температуры давление пара может стать выше равновесного давления пара над жидкостью или твердым телом и в газообразной фазе возникает новая жидкая или твердая фаза. Система становится гетерогенной, образуются аэрозоли (туман, дым).
-
Замена растворителя. Если насыщенный раствор канифоли в этиловом спирте влить в большой объем воды, то полученный раствор в спирто-водной среде оказывается пересыщенным. Пересыщение приводит к агрегированию частиц канифоли, система становится гетерогенной, образуется коллоидная система – золь канифоли.

В области 1 скорость нуклеации достаточна, но скорость роста кристаллов невелика, так как концентрация небольшая. Поэтому образуется коллоидная система - золь. В области 2 с увеличением концентрации роста увеличивается, частицы быстро укрупняются и под действием силы тяжести оседают, образуется осадок. В области 3 при высокой концентрации вещества, образующего дисперсную фазу, вязкость возрастает, скорость диффузии вещества из раствора к поверхности зародыша уменьшается. При высокой скорости нуклеации образуется много мелких частиц, которые соединяются друг с другом, образуя структированную коллоидную систему – гель.
-
Гетерогенная конденсация
Если в метастабильной фазе имеются какие-либо поверхности или какие-то посторонние включения, которые могут способствовать образованию и росту зародыша, при этом необходимо, чтобы образовавшиеся зародыши изибирательно смачивались.

-
Принцип построения мицелл ионостабилизированных золей. Пример
Мицелла — это отдельная частица дисперсной фазы коллоидной системы с жидкой дисперсионной средой, состоящая из кристаллического или аморфного ядра и поверхностного слоя, включающего сольватно связанные молекулы окружающей жидкости.
![]()
Избыток одного из компонентов действует как стабилизатор коллоидного раствора. Пусть в избытке находится BaCl2. Вначале образуется агрегат мицеллы, являющийся мельчайшим кристалликом.
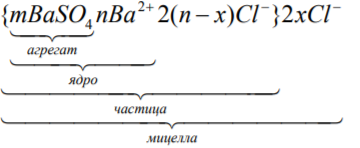
На поверхности кристалла имеются вакантные места, которые занимают ионы Ba2+. Таким образом, ионы вследствие избирательной ионной адсорбции достраивают кристаллическую решетку. Они придают положительный заряд поверхности ядра и называются потенциалопределяющими ионами (ПО-ионами). Ионы Cl-, образовавшиеся при диссоциации, имеют заряд, противоположный заряду поверхности. Под действием электростатических сил ионы притягиваются к ядру, нейтрализуя его заряд.
Противоионы находятся в тепловом движении. Часть противоионов (nx) , находящихся в непосредственном близости от ядра, связаны с ним помимо электростатических сил адсорбционными силами. Другая часть противоионов x, находящаяся вследствие теплового движения и электростатического отталкивания между одноименно заряженными ионами, находится на некотором удалении от ядра, образуя диффузионный слой. Таким образом, вокруг мицеллы существует двойной электрический слой, стабилизирующий мицеллу. Заряды потенциалопределяющих ионов и противоионов полностью скомпенсированы, поэтому мицелла электронейтральна.

