- •Химический элемент. Периодический закон.
- •Окислительные и восстановительные свойства атомов, валентность, электроотрицательность.
- •Химическая связь.
- •Химические реакции.
- •Количественные зависимости в химии.
- •Классы неорганических соединений и генетические ряды.
- •Электролитическая диссоциация и гидролиз солей.
- •Характеристики химических элементов.
- •Углерод в органических соединениях.
- •Гомологические ряды углеводородов.
- •Химические свойства углеводородов.
- •Производные углеводородов.
- •Углеводы.
- •Аминокислоты и белки.
Химическая связь.
№ |
Вопрос |
Ответ |
|
Что такое химическая связь и каковы виды химической связи? |
Химическая связь - связь между атомами и их группами, которая обеспечивается либо перекрыванием электронных облаков (ковалентная связь), либо электростатическим притяжением заряженных частиц (ионная, металлическая, водородная). |
|
Как устроена ковалентная связь? |
Ковалентная связь - связь, образующаяся за счёт перекрывания электронных облаков (создания общей электронной пары).
Различают ковалентную полярную и ковалентную неполярную связь. Ковалентная неполярная - такая ковалентная связь, при которой электронная плотность (область перекрывания облаков) не смещена ни к одному атому. Такая связь бывает между одинаковыми атомами: H2, Cl2, N2. (см. изображение молекулы водорода на предыдущем рисунке). Структурная формула молекулы водорода Н:Н (двоеточие обозначает общую электронную пару, она расположена симметрично относительно ядер (относительно букв H). Ковалентная полярная - такая ковалентная связь, при которой электронная плотность (область перекрывания электронных облаков) сдвинута к одному из атомов ( к тому, который обладает большей электроотрицательностью). Пример: молекула НCl, в которой область наибольшей электронной плотности сдвинута к хлору, в результате чего водородный край молекулы HCl заряжен положительно (с него как бы частично стянута электронная оболочка), а “хлоровый” край молекулы заряжен отрицательно. Такая молекула (с неодинаковым зарядом разных своих краёв) называется дипОль (т.е. двухполюсная). Структурная формула молекулы хлороводорода: H :Cl (электронная пара сдвинута к хлору). |
|
Как устроена ионная связь? |
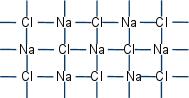
Ионная связь возникает между атомами с большой разницей в электроотрицательностях. Один атом полностью отбирает электрон (электроны) у другого атома и в результате эти атомы притягиваются как противоположно заряженные, т.е. как ионы. Пример: молекула NaCl. Хлор отбирает электрон внешнего (третьего) уровня у натрия, натрий становится положительным ионом, хлор становится отрицательным ионом, натрий и хлор притягиваются. Поскольку в реальности мы имеем дело не с одним атомом хлора и одним атомом натрия, то ионы натрия и ионы хлора притягиваются друг к другу, создавая упорядоченную структуру, в которой каждый атом хлора окружён шестью атомами натрия, а каждый атом натрия окружён шестью атомами хлора. Такую структуру называют кристаллической решёткой. Получается, что никакой молекулы NaCl нет, ведь любой атом хлора в кристаллической решётке связан с шестью атомами натрия, а любой атом натрия - с шестью атомами хлора. Запись NaCl обозначает не молекулу, а только количественное соотношение атомов натрия и атомов хлора в решётке: 1:1. Структурная формула хлорида натрия в плоскости выглядит так:
Каждый атом натрия окружён четырьмя атомами хлора, каждый атом хлора - четырьмя атомами натрия; остальные атомы находятся в других плоскостях, в узлах кубической решётки. |
|
Как устроена металлическая связь? |
Металлическая связь характерна для металлов. Строение металлов таково, что атомы представляют собой ионы, вокруг которых двужется множество свободных электронов (не привязанных к конкретному атому). таким образом все положительные ионы притягиваются ко всем свободным электронам (свободные электроны называют ещё электронным газом). Такое строение обуславливает электрическую проводимость металлов: именно свободные электроны "ответственны" за электрический ток в металлах. |
|
Как устроена водородная связь? |
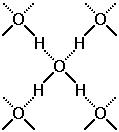
Водородная связь возникает МЕЖДУ МОЛЕКУЛАМИ, а не между атомами. Такая связь образуется между дипОлями. Чаще всего диполями являются молекулы, в которые входят атомы водорода: электронная плотность почти всегда смещена от них в сторону другого атома, в результате чего водородный край молекулы имеет положительный заряд, а другие края - отрицательный. Такие молекулы будут располагаться в пространстве так, чтобы положительный край одной молекулы находился рядом с отрицательным краем другой молекулы. Пример: связь между молекулами воды.
Водородные связи обозначены пунктиром. |