
- •Введение
- •Титриметрические методы анализа
- •Растворы, применяемые в титриметрическом методе анализа
- •Способы титрования
- •Кислотно-основноЕ титрованиЕ
- •Лабораторная работа 1 Определение содержания уксусной кислоты в растворе методом кислотно-основного титрования
- •Приготовление первичного стандарта янтарной кислоты hoocch2ch2cooh.
- •Приготовление и стандартизация титранта (раствора NaOh).
- •Определение содержания уксусной кислоты в исследуемом растворе
- •4. Статистическая обработка результатов анализа [5].
- •Лабораторная работа 2 Определение содержания этилендиамина в растворе методом кислотно-основного титрования
- •1. Приготовление первичного стандарта карбоната натрия (Na2co3).
- •2. Приготовление и стандартизация титранта (раствора hCl)
- •3. Определение содержания этилендиамина в исследуемом растворе
- •Статистическая обработка результатов анализа
- •Контрольные вопросы и задачи к лабораторным работам № 1,2 Теоретические вопросы
- •Практические вопросы
- •Комплексонометрическое титрование
- •2) Комплексон II (этилендиаминтетрауксусная кислота, эдту, h4y)
- •Расчетные формулы для построения кривых титрования в комплексонометрии
- •Классификация методов комплексонометрического титрования
- •Лабораторная работа 3 Определение содержания кальция (II) и магния (II) в растворе при совместном присутствии методом комплексонометрии
- •1. Стандартизация титранта – раствора эдта (Na2h2y)
- •4. Статистическая обработка результатов анализа
- •Лабораторная работа 4 Определение содержания меди(II) в растворе методом комплексонометрии
- •1. Стандартизация титранта - раствора эдта (Na2h2y).
- •2. Определение содержания меди (II) в растворе.
- •3. Статистическая обработка результатов анализа
- •Контрольные вопросы и задачи к лабораторным работам № 3 и № 4 Теоретические вопросы
- •Окислительно-восстановительное титрование
- •Кривые титрования
- •Константа равновесия редокс-реакции
- •Индикация точки эквивалентности при окислительно-восстановительном титровании
- •Перманганатометрия
- •Хроматометрия
- •Йодметрия
- •Йодатометрия
- •Лабораторная работа 5 Определение содержания меди (II) в растворе методом йодометрического титрования
- •1 Приготовление и стандартизация рабочего раствора тиосульфата натрия (Na2s2o3)
- •2. Определение содержания меди (II) в исследуемом растворе
- •3. Статистическая обработка результатов анализа
- •4. Статистическая обработка результатов определения содержания меди (II) в растворе, полученных двумя методами (комплексонометрия и йодометрия).
- •Контрольные вопросы и задачи к лабораторной работе № 5 Теоретические вопросы
- •Броматометрия
- •Лабораторная работа 6 Определение содержания фенолфталеина в растворе методом бромид-броматометрии с йодОметрическим окончанием
- •Сущность метода определения фенолфталеина
- •1. Приготовление стандартного раствора бромата калия.
- •2. Стандартизация рабочего раствора Na2s2o3 (стандартизовать, не разбавляя!)
- •3. Приготовление анализируемого спиртового раствора фенолфталеина
- •4. Определение содержания фенолфталеина
- •5. Статистическая обработка результатов анализа
- •Контрольные вопросы и задачи к лабораторной работе № 6 Теоретические вопросы
- •Нитритометрия
- •Лабораторная работа 7 Анализ лекарственных препаратов производных п-аминобензолсульфаниламида методом нитритометрии
- •1. Стандартизация раствора NaNo2.
- •2. Определение содержания сульфаниламида в препарате
- •Статистическая обработка результатов анализа
- •Контрольные вопросы и задачи к лабораторной работе № 7
- •Библиографический список ПриложениЯ
2. Приготовление и стандартизация титранта (раствора hCl)
Раствор хлороводородной кислоты готовят объемом примерно 500 см3 с молярной концентрацией эквивалента примерно 0,05÷0,06 моль/дм3)
Титрант – раствор хлороводородной кислоты приблизительной концентрацией 0,05 моль/дм3 готовят из хлороводородной кислоты, разбавленной 1:1 (=1,095 г/см3).
Стандартизацию раствора HCl проводят по первичному стандарту Na2CO3 прямым титрованием, способом пипетирования.
Индикатор выбирают по кривой титрования карбоната натрия хлороводородной кислотой (рис. 4).

Рис. 4. Кривая титрования 100,00 см3 раствора Na2CO3 с С = 0,1000 моль/дм3 раствором HCl с С1/z = 0,1000 моль/дм3
При титровании до второй точки эквивалентности используют индикатор метиловый оранжевый, 0,1%-ный водный раствор (рТ = 4,0). Изменение окраски от желтой до оранжевой (цвет «чайной розы»). Интервал перехода (рН = 3,1 – 4,4) [6].
Схема 3. Стандартизация раствора HCl

В коническую колбу
для титрования вместимостью 250 см3
помещают
аликвоту 25,00 см3
стандартного раствора Na2CO3
(пипеткой), добавляют 2 – 3 капли метилового
оранжевого,
разбавляют
водой до 50 – 75 см3
и титруют раствором хлороводородной
кислоты до перехода окраски из желтой
в цвет «чайной розы» от одной капли
титранта. Титрование проводят в
присутствии «свидетеля» (исходный
раствор Na2CO3
с индикатором). Результаты титрования
заносят в табл. 4. Концентрацию
хлороводородной кислоты определяют по
закону эквивалентов:
![]() .
.
Таблица 4
Результаты стандартизации раствора соляной кислоты
№ опыта |
Объем Na2CO3, см3 |
Объем HCl, см3 |
Концентрация HCl, моль/дм3 |
Средняя концентрация HCl, моль/дм3 |
1 |
25,00 |
|
|
|
2 |
25,00 |
|
|
|
3 |
25,00 |
|
|
3. Определение содержания этилендиамина в исследуемом растворе
Методика определения аналогична стандартизации кислоты.
Основное уравнение титрования:
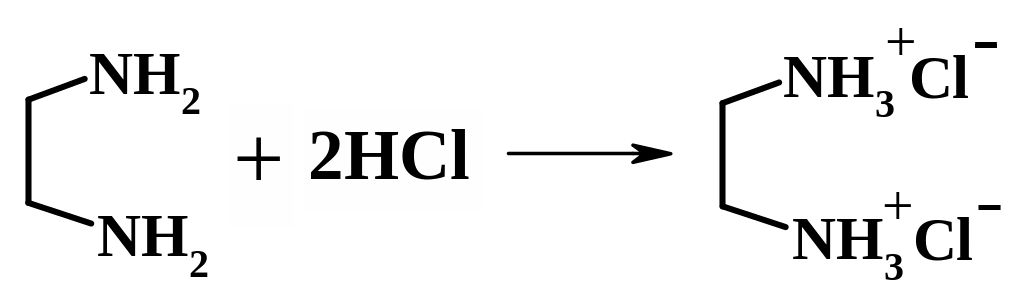
Кривую титрования этилендиамина (ЭДА) раствором соляной кислоты строят самостоятельно и выбирают индикатор.
Раствор задачи в мерной колбе доводят до метки дистиллированной водой и тщательно перемешивают.
Схема 4. Определение содержания этилендиамина в растворе

В коническую колбу для титрования вместимостью 250 см3 помещают аликвоту 25,00 см3 исследуемого раствора ЭДА (пипеткой), добавляют 2 – 3 капли смешанного индикатора (метиловый оранжевый и метиленовый синий), разбавляют водой 50 – 70 см3) и титруют стандартизованным раствором соляной кислоты до изменения окраски раствора от одной капли титранта из зеленой в фиолетовую. Результаты титрования заносят в табл. 5.
Таблица 5
Результаты титрования раствора этилендиамина
№ опыта |
Объем исследуемого раствора этилендиамина, см3 |
Объем HCl, см3 |
Содержание ЭДА в растворе, г |
1 |
25,00 |
|
|
2 |
25,00 |
|
|
3 |
25,00 |
|
|
4 |
25,00 |
|
|
5 |
25,00 |
|
|
