
- •Углеводороды
- •1. Электронное строение молекулы метана сн4:
- •Молекула метана имеет тетраэдрическое строение
- •Чтобы лучше понять, что такое первичный, вторичный, третичный и четвертичный атом углерода рассмотрим следующий пример – вещество в котором присутствуют все четыре типа атомов.
- •2,2,4 Триметилпентан
- •3. Номенклатура алканов.
- •4. Изомерия алканов.
- •6. Физические свойства предельных углеводородов.
- •7.Основные способы получения алканов.
- •8.Основные химические свойства алканов.
- •9. Применение алканов.
- •Строение циклопарафинов.
- •Изомерия циклопарафинов.
- •4. Физические свойства циклопарафинов.
- •Способы получения циклопарафинов.
- •Химические свойства циклопарафинов.
- •Применение циклопарафинов.
- •Электронное строение молекулы этилена.
- •2. Гомологический ряд алкенов. Построение названий алкенов.
- •3. Изомерия алкенов.
- •Нахождение алкенов в природе и способы их получения.
- •Физические свойства алкенов.
- •Химические свойства алкенов.
- •Номенклатура и строение диеновых углеводородов.
- •2. Классификация диеновых углеводородов.
- •3. Основные способы получения диеновых углеводородов.
- •4. Основные физические свойства некоторых диеновых углеводородов.
- •5. Некоторые химические свойства диеновых углеводородов.
- •6. Применение диеновых углеводородов.
- •Электронное строение молекулы ацетилена - c2h2:
- •2. Гомологический ряд алкинов.
- •3. Номенклатура алкинов.
- •4. Изомерия алкинов.
- •5. Основные способы получения некоторых алкинов.
- •6. Физические свойства алкинов.
- •7. Основные химические свойства некоторых алкинов.
- •8. Применение алкинов.
- •Литература.
- •Автор разработки: Демидов Владимир Александрович,
4. Изомерия алкинов.
А) Изомерия положения тройной связи.
СНС – СН2 – СН2 – СH3
пентин-1
СH3 – C C – CH2 – CH3
петин-2
Б) Изомерия углеродного скелета.
CH C – CH – CH2 – CH3
CH3
3-метилпентин-1
CH C – CH2 – CH – CH3
CH3
4-метилпентин-1
В) Изомерия веществ разных классов органических соединений.
C4H6 – данной формуле могут соответствовать следующие соединения:
CH C – CH2 – CH3 CH2 = CH – CH = CH2
бутин-1 бутадиен-1,2
5. Основные способы получения некоторых алкинов.
А) Взаимодействие карбида кальция с водой (лабораторный способ получения ацетилена).
СaC2 + 2H2O C2H2 + Ca(OH)2
карбид кальция ацетилен
Б) Взаимодействие дигалогенпроизводных алканов содержащих два атома галогена при одном или двух соседних углеродных атомов со спиртовым раствором щелочи.
CH3 – CH2 – CHCl2 + 2KOH CH3 – C CH + 2KCl + 2H2O
1,1-дихлорпропан пропин
В)Термическое разложение углеводородов нефти или газа.
1500oC
2CH4 C2H2 + 3H2
метан ацетилен
Г) Алкилирование металлических производных ацетилена.
CH3 – I + Na – C CH CH3 – C CH + NaI
монойодметан ацетилинид натрия пропин
6. Физические свойства алкинов.
Ацетиленовые углеводороды, содержащие в молекуле от двух до четырех атомов углерода (при обычных условиях), находятся в газообразном агрегатном состоянии. Алкины с C5H8 до С15Н28 при обычных условиях находятся в жидком агрегатном состоянии. Начиная с С16Н30 и выше алкины являются твердыми веществами. Алкины хорошо растворимы в органических растворителях хуже – в воде. Наиболее значимым алкином является ацетилен – горячий газ в обычных условиях без цвета запаха и вкуса. Технический же ацетилен обладает неприятным запахом, обусловленным наличием различных примесей. С воздухом ацетилен образует взрывоопасные смеси.
7. Основные химические свойства некоторых алкинов.
А) Гидрирование алкинов на катализаторе.
t
CH CH + 2H2 CH3 – CH3
кат. Ni
ацетилен этан
Г) Взаимодействие алкинов с галогенами.
CH CH + 2Br2 CHBr2 – CHBr2
ацетилен 1,1,2,2-тетрабромэтан
В) Взаимодействие алкинов с галогенводородами.
CH CH + 2HCl CH3 – CHCl2
ацетилен 1,1-дихлорэтан
 Г)
Гидратация ацетилена (реакция М.Г.
Кучерова 1881г).
Г)
Гидратация ацетилена (реакция М.Г.
Кучерова 1881г).
HgSO4 O
CH CH + H2O [CH2 = CH – OH] CH3 – C
H2SO4 H
ацетилен виниловый спирт уксусный альдегид
Д) Взаимодействие алкинов с синильной кислотой.
CuCl2 + NH3
СH CH + HCN CH2 = CH – CN
ацетилен синильная к-та акрилонитрил
Е) Взаимодействие алкинов с органическими кислотами.
ZnO O
CH3 – COOH + CH CH CH3 – C
уксусная кислота ацетилен O – CH = CH2
(этановая) винилацетат
Ж) Взаимодействие алкинов со спиртами.
KOH
CH CH + HOC2H5 CH2 = CH – O – C2H5
ацетилен этанол 150-200oC этилвиниловый эфир
З) Полимеризация алкинов.

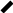
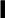 CH CH 450oC
CH CH 450oC
HC +
 HC CH
акт. уголь
HC CH
акт. уголь
CH
бензол
И) Взаимодействие ацетилена с аммиачным раствором оксида серебра.
HC CH + 2[Ag(NH3)2]OH Ag – C C – Ag + 4NH3 + 2H2O
ацетилен ацетиленид серебра
К) Конденсация алкинов с карбонильными соединениями.
O 40o OH H2
CH3 –C – CH3 + H – C C – H CH3 – C – C CH
ацетон KOH CH3
H HO
CH2 – C – CH = CH2 CH2 = C – CH = CH2
CH3 -H2O CH3
изопрен
Л) Окисление алкинов.
3CH CH + 8KMnO4 3K2C2O4 + 8MnO2 + 2KOH + 2H2O
ацетилен оксалат калия
М) Горение алкинов.
2СH CH + 5O2 4CO2 + 2H2O
ацетилен
