
- •Часть 1
- •Тема 1. Основные и технологические понятия и определения.
- •§ 1. Классификация моделей хтс.
- •1) Функциональная (принципиальная)
- •1) Основные операторы:
- •Вспомогательные операторы:
- •§ 2. Типы технологических связей хтп.
- •1) Последовательная; 2) Параллельная; 3) Обводная (байпас); 4) Рециркуляционная;
- •§ 3 Классификация химических реакций применяемых в промышленности.
- •1) Гомо и гетерофазные процессы.
- •2) Гомо и гетерогенные процессы.
- •3) Простые и сложные реакции.
- •4) Элементарные и неэлементарные реакции.
- •§ 4 Безразмерные характеристики материального баланса.
- •§ 5 Материальный баланс и его характеристики (простые реакции).
- •§ 6 Тепловой баланс и хтп и его характеристика.
- •Тема 2. Прикладная термодинамика химических процессов.
- •§ 1. Расчет тепловых эффектов химических реакций.
- •§ 2. Термодинамическая вероятность протекания химических реакций.
- •§ 3. Расчет равновесия обратимых химических реакций.
- •Закон действующих масс.
- •§ 4. Экспериментальное определение равновесного состава реакционной массы и константы равновесия.
- •§ 6. Законы смешения равновесия.
- •I) Давление.
- •II) Концентрация веществ.
- •III) Температура.
- •Тема 3: Кинетика гомогенных химических процессов.
- •§ 1 Скорость химических процессов.
- •Зависимость скорости химической реакции от концентрации исходных веществ. Основной закон кинетики.
- •1) Метод.
- •2) Метод
- •Зависимость скорости химической реакции от температуры. Общее кинетическое уравнение.
- •§2 Исследование кинетики гомогенных химических реакций.
- •Исследование гомогенных химических реакций в реакторах периодического действия емкостного типа.
- •Интегральный метод анализа кинетической зависимости.
- •Тема 4: Особенности кинетики гетерогенных каталитических процессов (гкп).
- •§1 Основные стадии гкп. Общее уравнение кинетики.
- •1) Внешнедиффузионная.
- •2) Внутренняя диффузия.
- •4) Химическое превращение.
- •§2 Внешнедиффузионная и внутредиффузионная области, лимитирующие в гетерогенном каталитическом процессе.
- •§3 Адсорбция на поверхности катализатора.
- •Основные положения теории:
- •§5. Кинетика реакции на поверхности катализаторов (кинетическая область, как лимитирующая гкп).
- •§6 Исследование кинетики гкп.
- •§7 Определение лимитирующей стадии гкп.
- •Часть 2 Основы расчета химических реакторов. Классификация химических реакторов.
- •Тема 1. Расчет изотермических реакторов для проведения гомогенных реакций..
- •§ 1. Реактор рис-п.
- •§ 2. Реактор идеального смешения рис-н.
- •§ 3. Реактор идеального вытеснения рис-в.
§ 3 Классификация химических реакций применяемых в промышленности.
В современной химии известно огромное количество различных химических реакций. Многие из них осуществляются в промышленных условиях и становятся объектом исследования инженерной химии.
Рассмотрим наиболее общую классификацию.
Классификация химических реакций:
1) Гомо и гетерофазные процессы.
Гомофазными – называются процессы, все компоненты которых находятся в пределах одной фазы: газовые (газофазные), жидкие (жидкофазные).
Гетерофазные процессы - это реакции, компоненты которой находятся в двух или более фазах.
Г – Ж (газ-жидкость); Ж – Ж (жидкость-жидкость); Г – ТТ – Ж (газ-твердое тело-жидкость).
2) Гомо и гетерогенные процессы.
Эти процессы различают по зоне протекания химических реакций.
Гомогенные процессы осуществляются в объеме какой-либо фазы, гетерогенные на поверхности раздела фаз. Понятие фазового состояния компонентов реакции и зоны ее протекания не однозначны. Существуют гомофазные гетерогенные процессы.
Например: гомофазная реакция на твердом катализаторе.
![]()
Гетерофазная гомогенная реакция. Сульфирование бензола серной кислотой, когда реагенты находятся в двух не смешивающихся фазах, а их взаимодействие идет в объеме одной из фаз.
![]()
3) Простые и сложные реакции.
Простыми называются реакции в которых не образуется измеримые или существенные для материального баланса количество других веществ, кроме тех, что записаны в стехеометрическом уравнении.
![]()
Простые реакции бывают необратимые (→)
и обратимые (![]() ).
).
Сложные реакции состоят из двух или более макростадий. Они дают ряд макропродуктов и представляют собой совокупность простых реакций.
![]()
Простые реакции 1 и 2 называют последовательными, а реакции 1 и 3 параллельными. Вещества А и В – реагенты; остальные продукты; С – целевой продукт; Д, F – побочные продукты; R – промежуточный продукт.
4) Элементарные и неэлементарные реакции.
Простые реакции могут быть элементарными и неэлементарными. Элементарные реакции протекают непосредственном взаимодействии исходных реагентов, то есть отсутствии, или их пока не удалось обнаружить, в каких либо микростадий, через которые протекает реакция.
А+В → С+Д
Не элементарные реакции имеют ряд химических микростадий, в которых участвуют промежуточные комплексы или частицы не фигурирующие в стехеометрическом уравнении.
1)
![]()
2)
![]()
3)
![]()
Из всего следует что А+В→С+Д
Каждая из промежуточных стадий составляют не элементарную реакцию, является элементарной. Совокупность элементарных реакций, способов образование природы и дальнейших взаимодействий промежуточных комплексов и частиц составляют механизмы реакции. В зависимости от числа молекул комплексов и частиц, участвующих в элементарной реакции. Последнее бывают моно- ; би- ; и тримолекулярные.
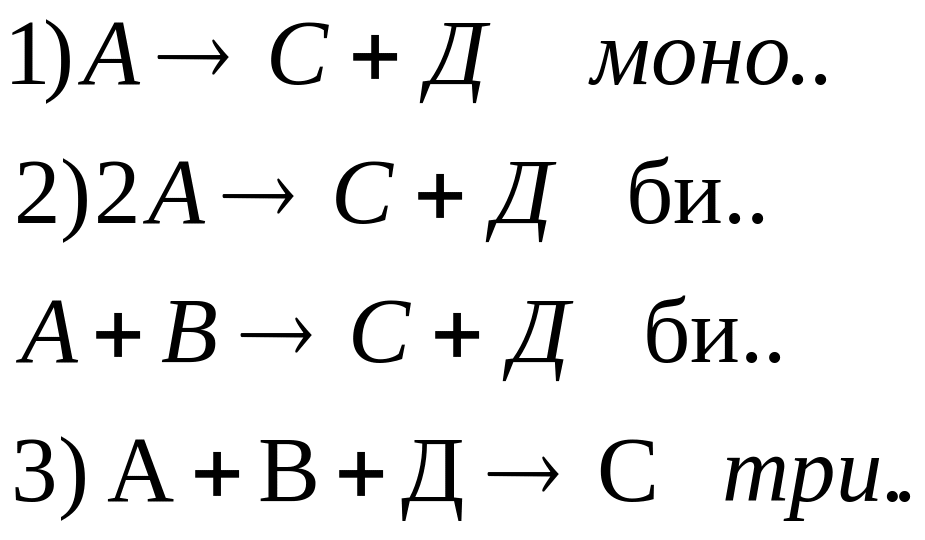
§ 4 Безразмерные характеристики материального баланса.
Для оценки эффективности ХТП в инженерной химии применяют ряд критериев. В качестве таких критериев используют производительность, интенсивность, степень превращения (конверсия) реагента.
Выход продукта, селективность.
Производительность – это количество выработанного продукта или переработанного сырья в единицу времени.

Максимальновозможная для данного реактора (агрегата, отделения, производства) производительность называется мощностью.
Интенсивность – это производительность,
отнесенная какой-либо величине,
характеризующей размеры реактора, его
объему (V) к сечению (S).
![]() .
Интенсивность используют для сравнения
работы ректоров различного устройства,
в которых протекают одни и те же химические
процессы. Степень превращения реагента
– это доля реагента использованного
на химическую реакцию. Степень превращения
реагента показывает на сколько полно
в химическом процессе используется
исходное сырье.
.
Интенсивность используют для сравнения
работы ректоров различного устройства,
в которых протекают одни и те же химические
процессы. Степень превращения реагента
– это доля реагента использованного
на химическую реакцию. Степень превращения
реагента показывает на сколько полно
в химическом процессе используется
исходное сырье.
![]() .
xi –
степень превращения реагента; Yi,0
– количество i-ого
реагента в исходной реакционной цепи.
Yi –
количество i-ого
реагента в конце процесса.
.
xi –
степень превращения реагента; Yi,0
– количество i-ого
реагента в исходной реакционной цепи.
Yi –
количество i-ого
реагента в конце процесса.
Для обратимых реакций предельным
состоянием является состояние химического
равновесия. Этому состоянию соответствует
предельно-достижимое равновесная
степень превращения.
![]() ,
xi
* - равновесная степень
превращения, Yi
– количество i-ого
реагента в условиях равновесия.
,
xi
* - равновесная степень
превращения, Yi
– количество i-ого
реагента в условиях равновесия.
Когда реакция протекает без изменения
объема, степень превращения реагента
может быть выражена через концентрацию
этого реагента: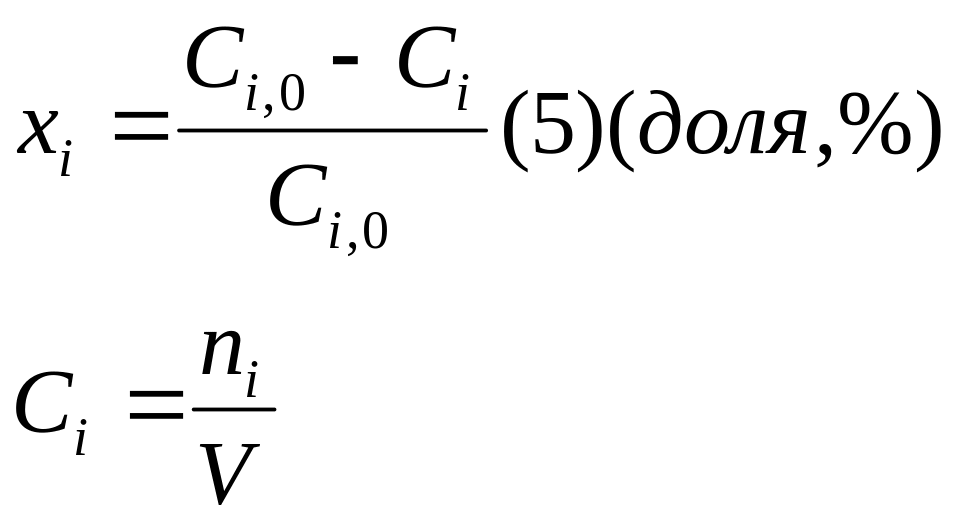
ni
- количество молей i-ого
реагента; V – объем
реакционной массы в которой это все
находится. Если объем реакционной массы
изменяется во время протекания химической
реакции и это изменение можно считать
линейными, то можно записать:
![]() ;
Vi – объем реакционной
массы в конце; Vi,0
– в конце. ε – коэффициент относительно
изменения объема.
;
Vi – объем реакционной
массы в конце; Vi,0
– в конце. ε – коэффициент относительно
изменения объема.
![]() ,
где объем при Vx=1 и V
при x = 0, это мольные объемы
реакционной массы при степени превращения
равной 1 или 0. Vx=1 – нет
реагентов, только продукты, Vx=0
– только реагенты.
,
где объем при Vx=1 и V
при x = 0, это мольные объемы
реакционной массы при степени превращения
равной 1 или 0. Vx=1 – нет
реагентов, только продукты, Vx=0
– только реагенты.
С учетом уравнения (6) текущую концентрацию реагента в реакционной массе можно представить:
![]() ,
а степень превращения xi
может быть найдено:
,
а степень превращения xi
может быть найдено:
![]()
Выход продукта – это отношение,
фактически полученного количества
продукта к максимально возможному его
количеству, которое может быть получено
в соответствии со стехиометрией
химической реакции.
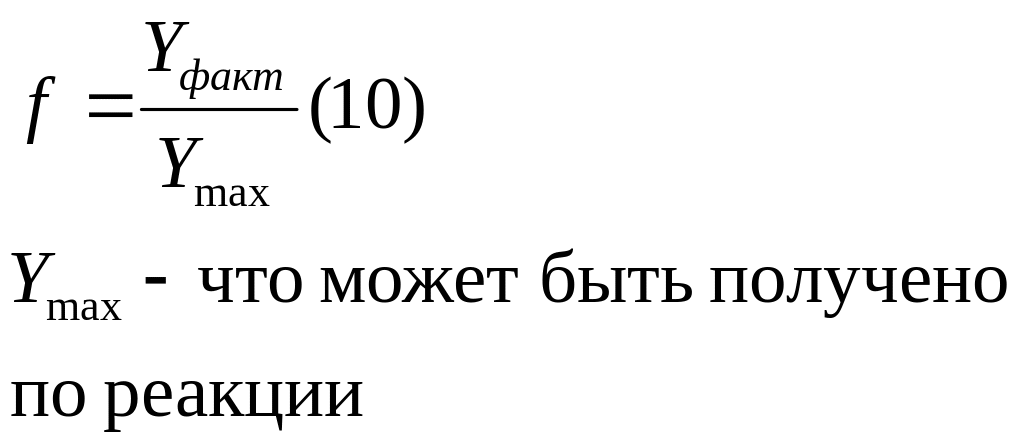 .
Следует отметь, что величина Ymax
– зависит от типа химической реакции:
1) Рассмотрим необратимую химическую
реакцию.
.
Следует отметь, что величина Ymax
– зависит от типа химической реакции:
1) Рассмотрим необратимую химическую
реакцию.
![]()
Для простых необратимых реакций выход продукта равен степени превращения реагента.
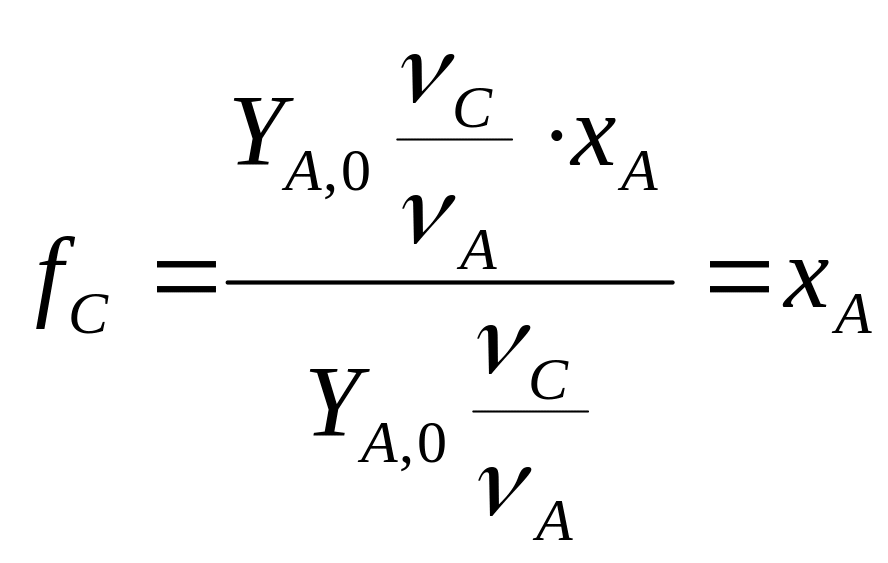 ;
2) Для обратимой химической реакции:
;
2) Для обратимой химической реакции:
 .
3) Для сложных параллельных и последовательных
необратимых реакций.
.
3) Для сложных параллельных и последовательных
необратимых реакций.
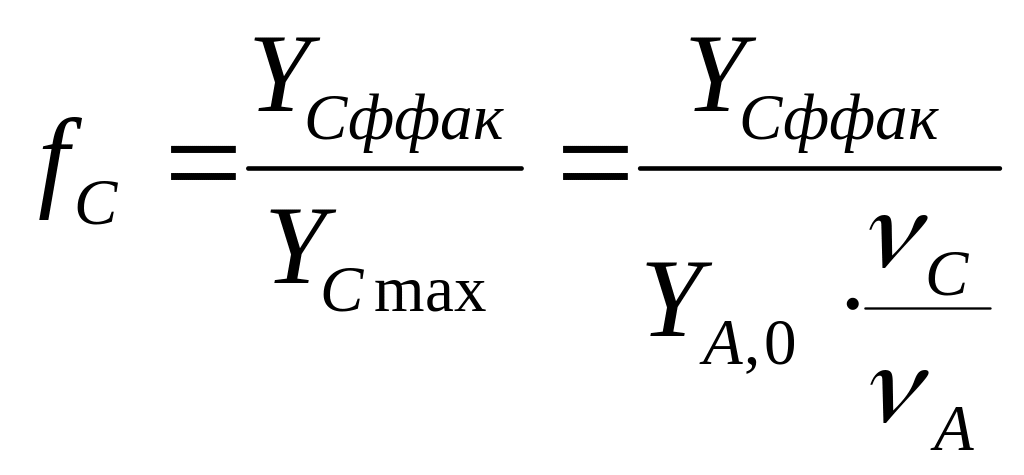 .
4) Для сложных параллельных и последовательных
обратимых реакций.
.
4) Для сложных параллельных и последовательных
обратимых реакций.
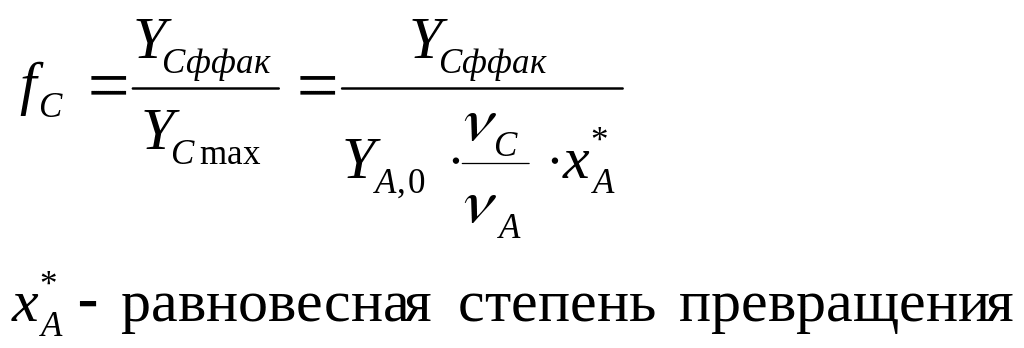
Селективность – это доля превращения реагента, израсходованного на образование целевого продукта. Различают интегральную и дифференциальную селективность.
1) Дифференциальная (φ) – это отношение
скорости превращения реагента в целевой
продукт к суммарной скорости расходования
исходного реагента, то есть доля исходного
реагента претерпевшая за некоторый
промежуток времени превращения в целевой
продукт.
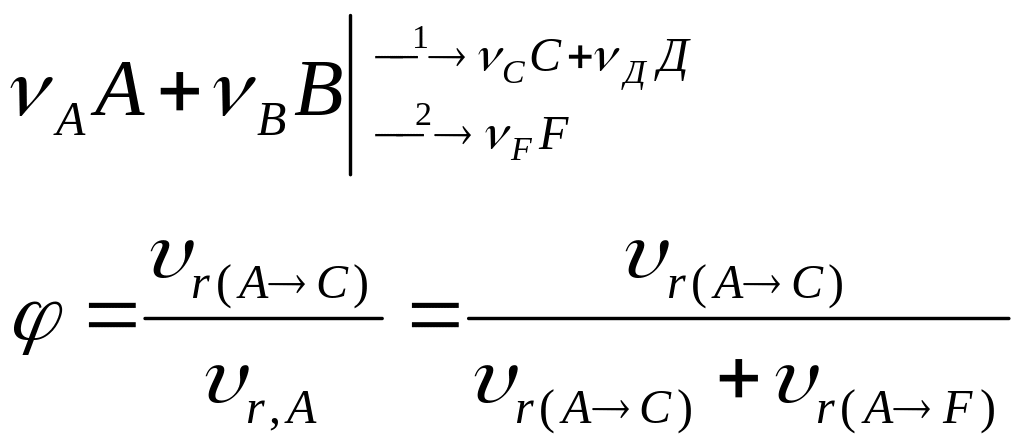 2)
Интегральная (Фс) - это отношение
количества исходного реагента,
расходуемого на целевую реакцию к общему
количеству реагента пошедшего на
реакцию, то есть доля реагента
превратившегося в целевой продукт.
2)
Интегральная (Фс) - это отношение
количества исходного реагента,
расходуемого на целевую реакцию к общему
количеству реагента пошедшего на
реакцию, то есть доля реагента
превратившегося в целевой продукт.
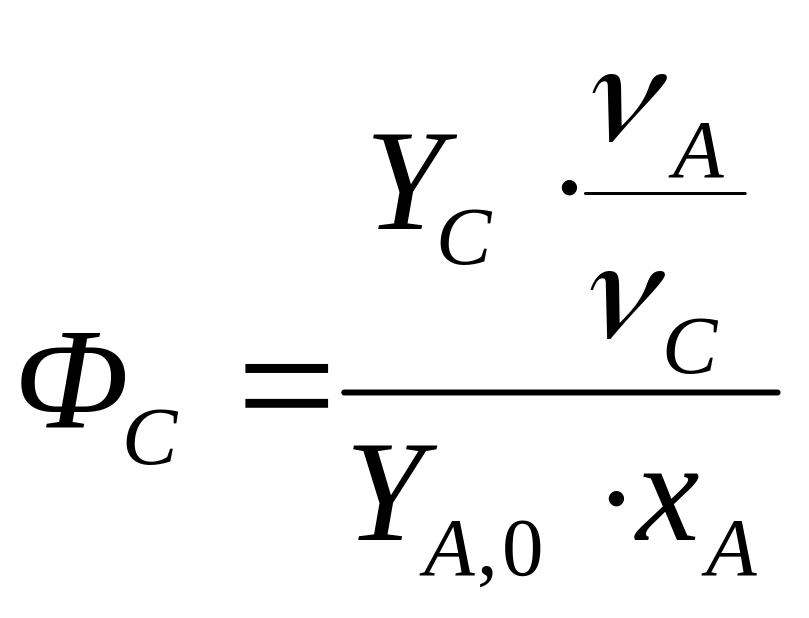 .
Связь между выходом продукта и
селективностью:
.
Связь между выходом продукта и
селективностью:
![]() .
Для обратимых реакций:
.
Для обратимых реакций:
![]()
