
- •Часть 1
- •Тема 1. Основные и технологические понятия и определения.
- •§ 1. Классификация моделей хтс.
- •1) Функциональная (принципиальная)
- •1) Основные операторы:
- •Вспомогательные операторы:
- •§ 2. Типы технологических связей хтп.
- •1) Последовательная; 2) Параллельная; 3) Обводная (байпас); 4) Рециркуляционная;
- •§ 3 Классификация химических реакций применяемых в промышленности.
- •1) Гомо и гетерофазные процессы.
- •2) Гомо и гетерогенные процессы.
- •3) Простые и сложные реакции.
- •4) Элементарные и неэлементарные реакции.
- •§ 4 Безразмерные характеристики материального баланса.
- •§ 5 Материальный баланс и его характеристики (простые реакции).
- •§ 6 Тепловой баланс и хтп и его характеристика.
- •Тема 2. Прикладная термодинамика химических процессов.
- •§ 1. Расчет тепловых эффектов химических реакций.
- •§ 2. Термодинамическая вероятность протекания химических реакций.
- •§ 3. Расчет равновесия обратимых химических реакций.
- •Закон действующих масс.
- •§ 4. Экспериментальное определение равновесного состава реакционной массы и константы равновесия.
- •§ 6. Законы смешения равновесия.
- •I) Давление.
- •II) Концентрация веществ.
- •III) Температура.
- •Тема 3: Кинетика гомогенных химических процессов.
- •§ 1 Скорость химических процессов.
- •Зависимость скорости химической реакции от концентрации исходных веществ. Основной закон кинетики.
- •1) Метод.
- •2) Метод
- •Зависимость скорости химической реакции от температуры. Общее кинетическое уравнение.
- •§2 Исследование кинетики гомогенных химических реакций.
- •Исследование гомогенных химических реакций в реакторах периодического действия емкостного типа.
- •Интегральный метод анализа кинетической зависимости.
- •Тема 4: Особенности кинетики гетерогенных каталитических процессов (гкп).
- •§1 Основные стадии гкп. Общее уравнение кинетики.
- •1) Внешнедиффузионная.
- •2) Внутренняя диффузия.
- •4) Химическое превращение.
- •§2 Внешнедиффузионная и внутредиффузионная области, лимитирующие в гетерогенном каталитическом процессе.
- •§3 Адсорбция на поверхности катализатора.
- •Основные положения теории:
- •§5. Кинетика реакции на поверхности катализаторов (кинетическая область, как лимитирующая гкп).
- •§6 Исследование кинетики гкп.
- •§7 Определение лимитирующей стадии гкп.
- •Часть 2 Основы расчета химических реакторов. Классификация химических реакторов.
- •Тема 1. Расчет изотермических реакторов для проведения гомогенных реакций..
- •§ 1. Реактор рис-п.
- •§ 2. Реактор идеального смешения рис-н.
- •§ 3. Реактор идеального вытеснения рис-в.
§ 2. Термодинамическая вероятность протекания химических реакций.
При исследовании сложных и простых обратимых химических реакций, возникает необходимость установить, какие реакции из нескольких обратимых термодинамически наиболее вероятны, и в каком направлении будут протекать эти реакции.
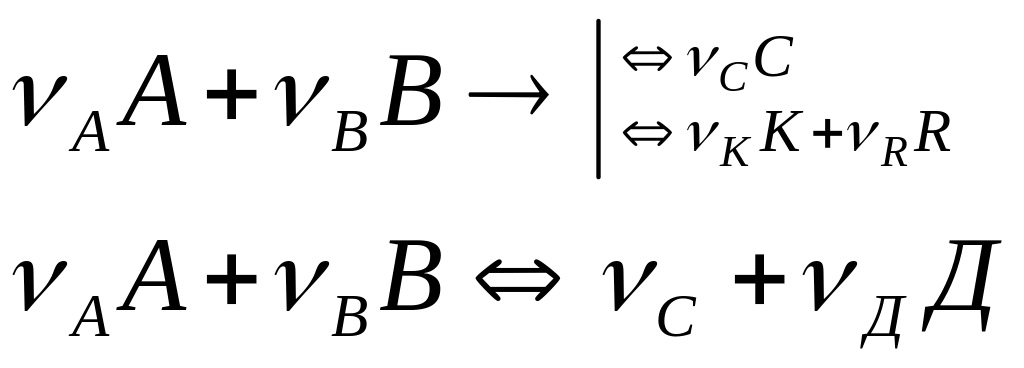 Мерой
сродства реагентов химических
взаимодействий в изобарно-изотермических
процессов служит энергия Гиббса (
Мерой
сродства реагентов химических
взаимодействий в изобарно-изотермических
процессов служит энергия Гиббса (![]() ).
Энергия Гиббса рассчитывается или
определяют на основе экспериментальных
данных.
).
Энергия Гиббса рассчитывается или
определяют на основе экспериментальных
данных.
![]()
![]() энергия Гиббса веществ участников
реакций при температуре 2980 К. νi
, νj –
стехиометрические коэффициенты. При
определении ΔG0 r
(свободная энергия) на основе
экспериментальных данных обычно
используют тепловой эффект реакции,
найденный опытным путем, пользуясь
уравнением:
энергия Гиббса веществ участников
реакций при температуре 2980 К. νi
, νj –
стехиометрические коэффициенты. При
определении ΔG0 r
(свободная энергия) на основе
экспериментальных данных обычно
используют тепловой эффект реакции,
найденный опытным путем, пользуясь
уравнением:
![]()
![]() - изменение энтропии реакции;
- изменение энтропии реакции;
![]()
νi и νj
– стехиометрические коэффициенты.
![]() - энтропия химических веществ при
температуре 2980 К. Если возникает
необходимость расчета энергии Гиббса
для реальных условий
- энтропия химических веществ при
температуре 2980 К. Если возникает
необходимость расчета энергии Гиббса
для реальных условий
![]() ,
то используют формулу Темкина-Шварцмана:
,
то используют формулу Темкина-Шварцмана:
![]()
Термодинамическая вероятность и направление протекания химически обратимых реакций определяется величиной и знаком энергии Гиббса. Существует следующая зависимость этой величины: 1) << 0, наиболее вероятно протекание химической реакции в прямом направлении (в сторону продуктов). 2) >> 0, наиболее вероятно протекание реакции в обратном направлении. (в сторону реагентов). 3) ≈ 0, термодинамическое равновесие.
При отсутствии экспериментальных данных для теплоемкости веществ, их можно рассчитать эмпирическими методами, для этого из большего числа, имеющихся в настоящее время эмпирических методов, могут быть рекомендовано: метод Маслова; метод Андерсена, Ватсона и Бай, метод Мэтьюза и Харда.
§ 3. Расчет равновесия обратимых химических реакций.
Все обратимые реакции во времени стремятся к равновесию, при которой скорости прямого и обратного процесса равны. В результате чего соотношение компонентов в реакционной массе остается неизменной пока в системе не изменяются параметры технологического режима (температура, давление, концентрации компонентов). При изменении параметров технологического режима равновесие в системе нарушается, самопроизвольно переходит в новое состояние, которому соответствует новое соотношение компонентов реакционной массы.
Закон действующих масс.
Подвижное равновесие обратимых химических реакций в химической технологии, количественно оценивается константами равновесия, которые выражаются законом действующих масс. Допустим, что в системе протекает жидкофазная обратимая реакция.
![]()
Как известно из общей химии, скорость прямой реакции пропорциональна произведению концентрации реагентов А и В (СА и СВ).
![]()
Скорость обратимых реакций пропорциональна произведению концентрации продуктов:
![]()
Из условий равенства скорости прямой и обратной реакции в момент равновесия:
![]() ,
получим, что константа равновесия:
,
получим, что константа равновесия:
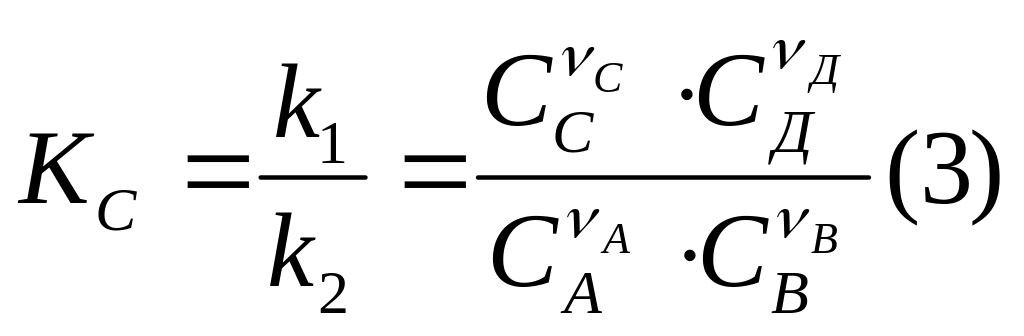 .
При анализе обратимых реакций в газовой
фазе константу равновесия выражают
через парциальные давления:
.
При анализе обратимых реакций в газовой
фазе константу равновесия выражают
через парциальные давления:
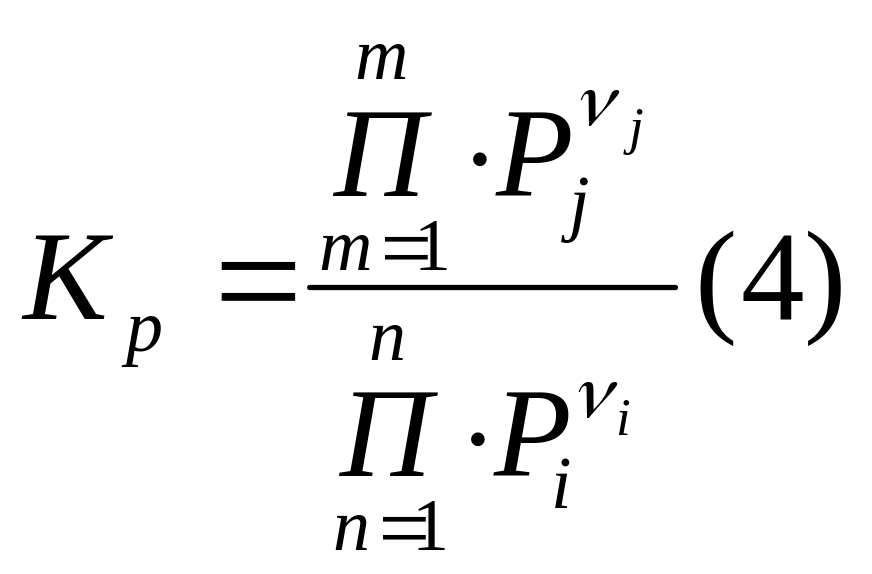 ;
Pi –
парциальное давление реагентов; Pj
– парциальное давление продуктов.
;
Pi –
парциальное давление реагентов; Pj
– парциальное давление продуктов.
Константу равновесия можно выразить
также через отношение мольных долей
участников реакции:
![]() ;
n – общее количество молей
содержащиеся в системе.
;
n – общее количество молей
содержащиеся в системе.
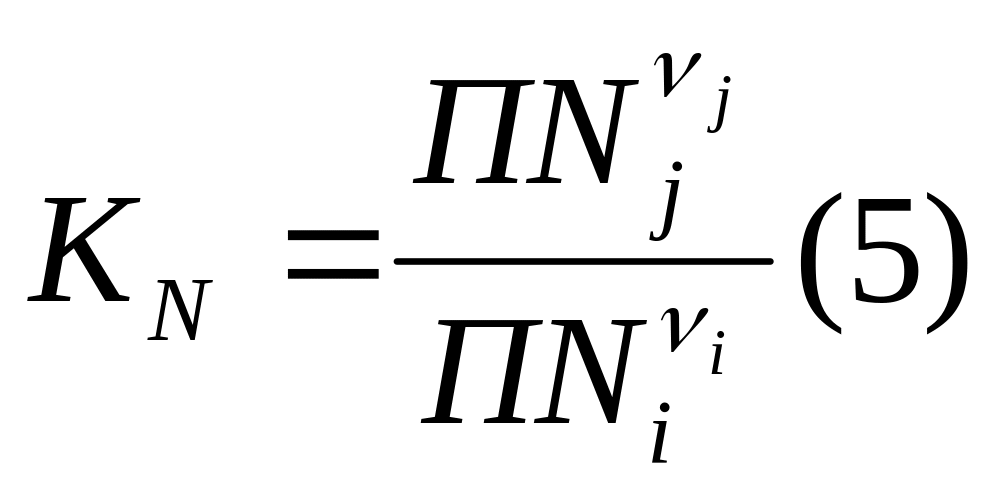 .
.
Константу равновесия можно выразить
через число молей компонентов.
![]() .
.
Для реальных систем, константу равновесия
выражают через летучесть «f»
или активность «а». При небольших
давлениях, практически при любых
температурах, соблюдают равенство:
![]() ,
Δn – изменение числа молей
входе химической реакции (для газообразных
реагентов):
,
Δn – изменение числа молей
входе химической реакции (для газообразных
реагентов):
![]() ,
при этом, надо помнить, что в зависимости
от типа химической реакции и использовании
исходных данных (концентрация, парциальное
давление), единицы измерения констант
равновесия, будут различны. В случае
уравнения (3) константа KC
– безразмерная величина. Но если в
реакторе осуществляется газообразная
реакция
,
при этом, надо помнить, что в зависимости
от типа химической реакции и использовании
исходных данных (концентрация, парциальное
давление), единицы измерения констант
равновесия, будут различны. В случае
уравнения (3) константа KC
– безразмерная величина. Но если в
реакторе осуществляется газообразная
реакция
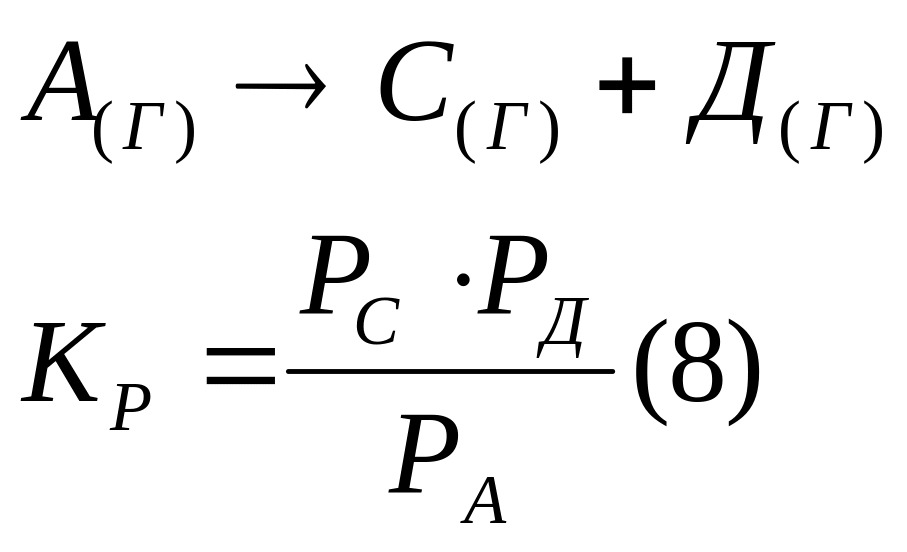 , единицы измерения константы равновесия
в этом случае [мПа, атм, бар].
, единицы измерения константы равновесия
в этом случае [мПа, атм, бар].
