
- •Часть 1
- •Тема 1. Основные и технологические понятия и определения.
- •§ 1. Классификация моделей хтс.
- •1) Функциональная (принципиальная)
- •1) Основные операторы:
- •Вспомогательные операторы:
- •§ 2. Типы технологических связей хтп.
- •1) Последовательная; 2) Параллельная; 3) Обводная (байпас); 4) Рециркуляционная;
- •§ 3 Классификация химических реакций применяемых в промышленности.
- •1) Гомо и гетерофазные процессы.
- •2) Гомо и гетерогенные процессы.
- •3) Простые и сложные реакции.
- •4) Элементарные и неэлементарные реакции.
- •§ 4 Безразмерные характеристики материального баланса.
- •§ 5 Материальный баланс и его характеристики (простые реакции).
- •§ 6 Тепловой баланс и хтп и его характеристика.
- •Тема 2. Прикладная термодинамика химических процессов.
- •§ 1. Расчет тепловых эффектов химических реакций.
- •§ 2. Термодинамическая вероятность протекания химических реакций.
- •§ 3. Расчет равновесия обратимых химических реакций.
- •Закон действующих масс.
- •§ 4. Экспериментальное определение равновесного состава реакционной массы и константы равновесия.
- •§ 6. Законы смешения равновесия.
- •I) Давление.
- •II) Концентрация веществ.
- •III) Температура.
- •Тема 3: Кинетика гомогенных химических процессов.
- •§ 1 Скорость химических процессов.
- •Зависимость скорости химической реакции от концентрации исходных веществ. Основной закон кинетики.
- •1) Метод.
- •2) Метод
- •Зависимость скорости химической реакции от температуры. Общее кинетическое уравнение.
- •§2 Исследование кинетики гомогенных химических реакций.
- •Исследование гомогенных химических реакций в реакторах периодического действия емкостного типа.
- •Интегральный метод анализа кинетической зависимости.
- •Тема 4: Особенности кинетики гетерогенных каталитических процессов (гкп).
- •§1 Основные стадии гкп. Общее уравнение кинетики.
- •1) Внешнедиффузионная.
- •2) Внутренняя диффузия.
- •4) Химическое превращение.
- •§2 Внешнедиффузионная и внутредиффузионная области, лимитирующие в гетерогенном каталитическом процессе.
- •§3 Адсорбция на поверхности катализатора.
- •Основные положения теории:
- •§5. Кинетика реакции на поверхности катализаторов (кинетическая область, как лимитирующая гкп).
- •§6 Исследование кинетики гкп.
- •§7 Определение лимитирующей стадии гкп.
- •Часть 2 Основы расчета химических реакторов. Классификация химических реакторов.
- •Тема 1. Расчет изотермических реакторов для проведения гомогенных реакций..
- •§ 1. Реактор рис-п.
- •§ 2. Реактор идеального смешения рис-н.
- •§ 3. Реактор идеального вытеснения рис-в.
II) Концентрация веществ.
1) Реагенты. В соответствии с принципом Ле Шателье, введение в равновесную систему дополнительных количеств какого либо вещества вызывает смещение равновесия в том направлении, в котором концентрация вещества уменьшается. Если концентрация реагентов (Среаг) увеличивается, то смещение в сторону продуктов . Поэтому введение избытков реагентов смещают равновесие в сторону продуктов.
2) Продукты. Во многих случаях смещения равновесия обратимой реакции можно осуществить и путем вывода продукта из реакционной зоны по мере его образования.
III) Температура.
Направление смещения равновесия при изменении температуры зависит от знака теплового эффекта реакции, повышение температуры всегда благоприятно для накопления веществ, образованных в результате реакции с поглощением тепла, то есть усиливается эндотермическое направление процесса.
1) Если
![]() равновесие
смещается в сторону продуктов
.
равновесие
смещается в сторону продуктов
.
2) Если
![]() то равновесие смещается в сторону
продуктов
.
(экзотермический процесс)
то равновесие смещается в сторону
продуктов
.
(экзотермический процесс)
Понижение температуры усиливает экзотермическое направление процесса. Следует отметить, что при изменении температуры, равновесие смещается тем сильнее, чем большим тепловым эффектом сопровождается та или иная химическая реакция.
Тема 3: Кинетика гомогенных химических процессов.
§ 1 Скорость химических процессов.
Существует ряд способов выражения скорости химической реакции. Для гомогенных систем используют уравнение:
![]()
Где νi – стехиометрический коэффициент при веществе dni ;
ni – концентрация i – ого вещества;
V – объем реакционной массы;
i – к реагенту; j – к продуктам.
Уравнение (1) используют со знаком « - », если скорость реакции определяется по одному из реагентов и со знаком «+», если скорость определяется по одному из продуктов реакции. Выражение (1) является строгим определением скорости химической реакции, и пригодна для расчета в случае переменного объема реакционной массы.
При постоянном значении объема реакционной массы, и равномерном распределении реагентов скорость реакции (υ) за интервал времени может быть найдена:
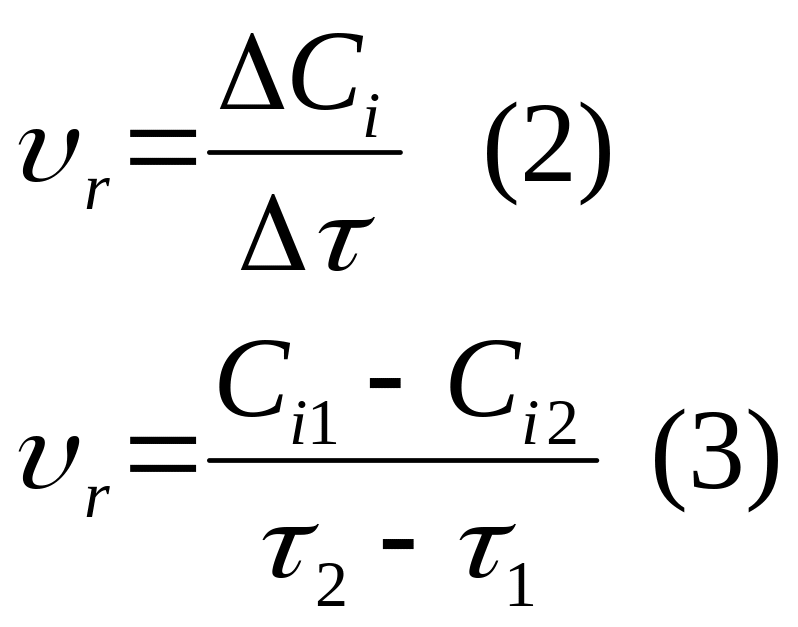
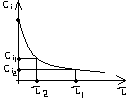 Рис 1
Рис 1
Истинная скорость химических реакций
определяется выражением:
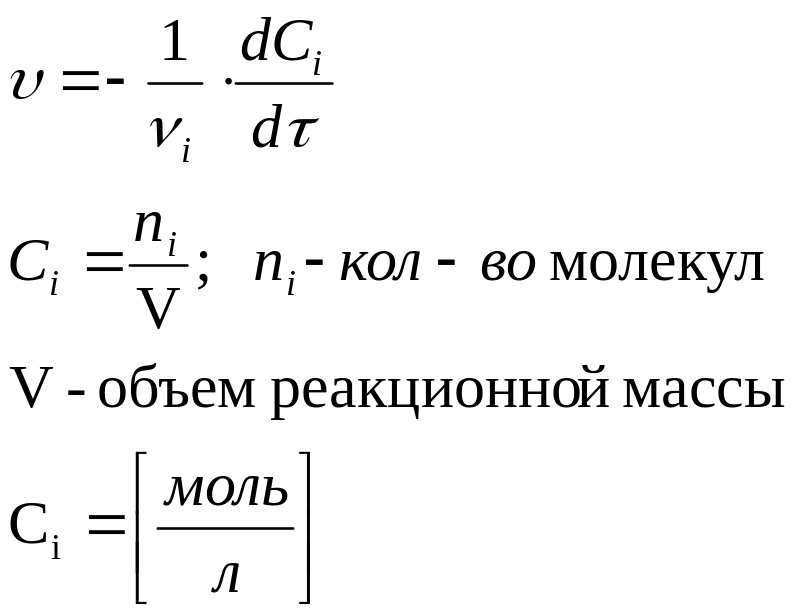
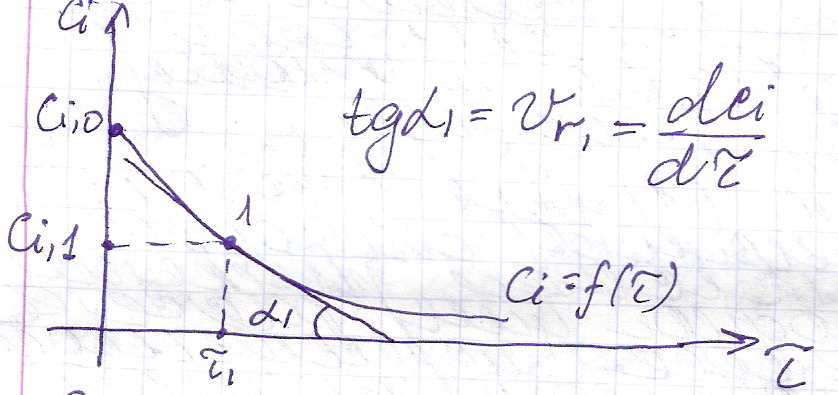
Определение средней и истинной скорости химической реакции выполняют по экспериментальной кинетической кривой Сi =f ( τ )/
Методы определения их показаны на графиках Рис 1 и Рис2.
Очень часто в инженерной химии, скорость химической реакции выражают через степень превращения xi .
![]()
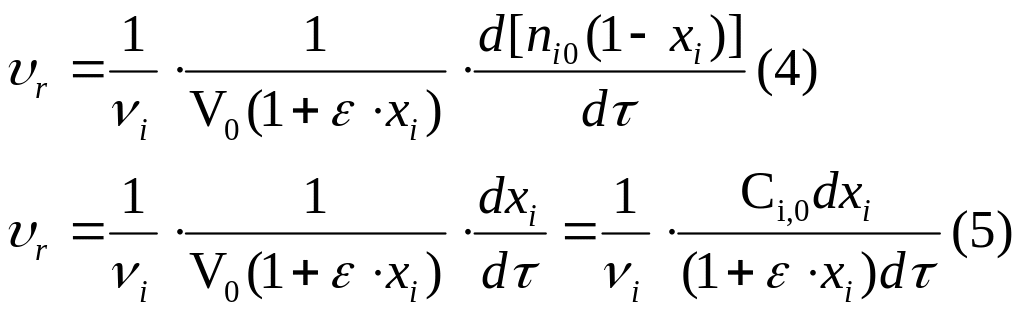
Если ε = 0, то
![]()
Зависимость скорости химической реакции от концентрации исходных веществ. Основной закон кинетики.
Согласно основному закону кинетики, скорость любой химической реакции в каждый момент времени пропорциональна произведению текущих концентрирующих веществ, возведенных в некоторые степени.
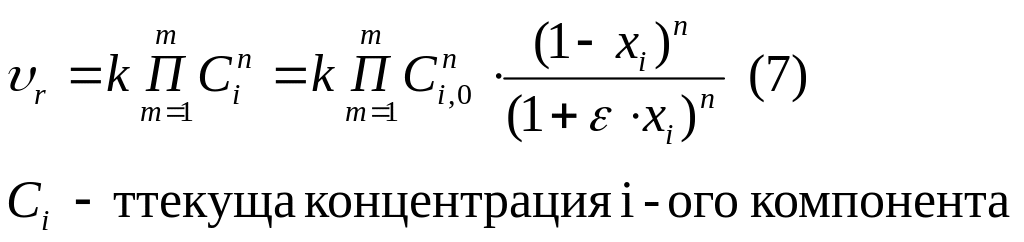
Уравнение (7), когда ε ≠ 0.
Если реакция протекает без изменения объема, то ε = 0, тогда
![]()
Где k – константа скорости химической реакции;
Сi,0 – начальная концентрация i-ого компонента;
xi - степень превращения i-ого компонента;
n –порядок реакции;
П – символ произведения;
Различают частный и общий порядок реакции.
Частный порядок (порядок по данному реагенту) - равен показателю степени концентрации реагента который входит в уравнение.
![]()
Порядок реакции имеет разный смысл для простых и сложных реакций.
Порядок простой реакции равен численно молей частиц, участвующих в элементарном акте. Он всегда положителен и целочисленный.
n = 1, 2, 3.
Если сложная реакция представляет ряд последовательных стадий, из которых только одна лимитирует (является самой медленной стадией) весь процесс, то порядок суммарной реакции обычно равен порядку этой лимитирующей стадии. В общем случае порядок сложной реакции может быть любым, целочисленным (дробным), переменным и даже отрицательным (для автокаталитической реакций).
Для того, чтобы найти общий порядок реакции достаточно в эксперименте исходные реагенты взять в стехиометрическом соотношении. Порядок реакции по данному реагенту можно определить, взяв все остальные реагенты в таком избытке, что их изменениями можно пренебречь.
Общий порядок реакций можно определить пользуясь следующими методами:
1)Метод основанный на зависимости начальной скорости реакции от исходных реагентов: υ r,0 = f (C i,0 ). 2)Метод основанный на зависимости текущей скорости реакции от текущей концентрации: υ r = f (C i)
