
- •Часть 1
- •Тема 1. Основные и технологические понятия и определения.
- •§ 1. Классификация моделей хтс.
- •1) Функциональная (принципиальная)
- •1) Основные операторы:
- •Вспомогательные операторы:
- •§ 2. Типы технологических связей хтп.
- •1) Последовательная; 2) Параллельная; 3) Обводная (байпас); 4) Рециркуляционная;
- •§ 3 Классификация химических реакций применяемых в промышленности.
- •1) Гомо и гетерофазные процессы.
- •2) Гомо и гетерогенные процессы.
- •3) Простые и сложные реакции.
- •4) Элементарные и неэлементарные реакции.
- •§ 4 Безразмерные характеристики материального баланса.
- •§ 5 Материальный баланс и его характеристики (простые реакции).
- •§ 6 Тепловой баланс и хтп и его характеристика.
- •Тема 2. Прикладная термодинамика химических процессов.
- •§ 1. Расчет тепловых эффектов химических реакций.
- •§ 2. Термодинамическая вероятность протекания химических реакций.
- •§ 3. Расчет равновесия обратимых химических реакций.
- •Закон действующих масс.
- •§ 4. Экспериментальное определение равновесного состава реакционной массы и константы равновесия.
- •§ 6. Законы смешения равновесия.
- •I) Давление.
- •II) Концентрация веществ.
- •III) Температура.
- •Тема 3: Кинетика гомогенных химических процессов.
- •§ 1 Скорость химических процессов.
- •Зависимость скорости химической реакции от концентрации исходных веществ. Основной закон кинетики.
- •1) Метод.
- •2) Метод
- •Зависимость скорости химической реакции от температуры. Общее кинетическое уравнение.
- •§2 Исследование кинетики гомогенных химических реакций.
- •Исследование гомогенных химических реакций в реакторах периодического действия емкостного типа.
- •Интегральный метод анализа кинетической зависимости.
- •Тема 4: Особенности кинетики гетерогенных каталитических процессов (гкп).
- •§1 Основные стадии гкп. Общее уравнение кинетики.
- •1) Внешнедиффузионная.
- •2) Внутренняя диффузия.
- •4) Химическое превращение.
- •§2 Внешнедиффузионная и внутредиффузионная области, лимитирующие в гетерогенном каталитическом процессе.
- •§3 Адсорбция на поверхности катализатора.
- •Основные положения теории:
- •§5. Кинетика реакции на поверхности катализаторов (кинетическая область, как лимитирующая гкп).
- •§6 Исследование кинетики гкп.
- •§7 Определение лимитирующей стадии гкп.
- •Часть 2 Основы расчета химических реакторов. Классификация химических реакторов.
- •Тема 1. Расчет изотермических реакторов для проведения гомогенных реакций..
- •§ 1. Реактор рис-п.
- •§ 2. Реактор идеального смешения рис-н.
- •§ 3. Реактор идеального вытеснения рис-в.
1) Метод.
При использовании первого метода проводят серию экспериментов с различными исходными концентрациями реагента А. (C А,01 , C А,02 , C А,03 ). Снимая экспериментальную зависимость C А = f (τ).
Для каждого опыта определяют известными методами начальную скорость реакции.
а) Графический.
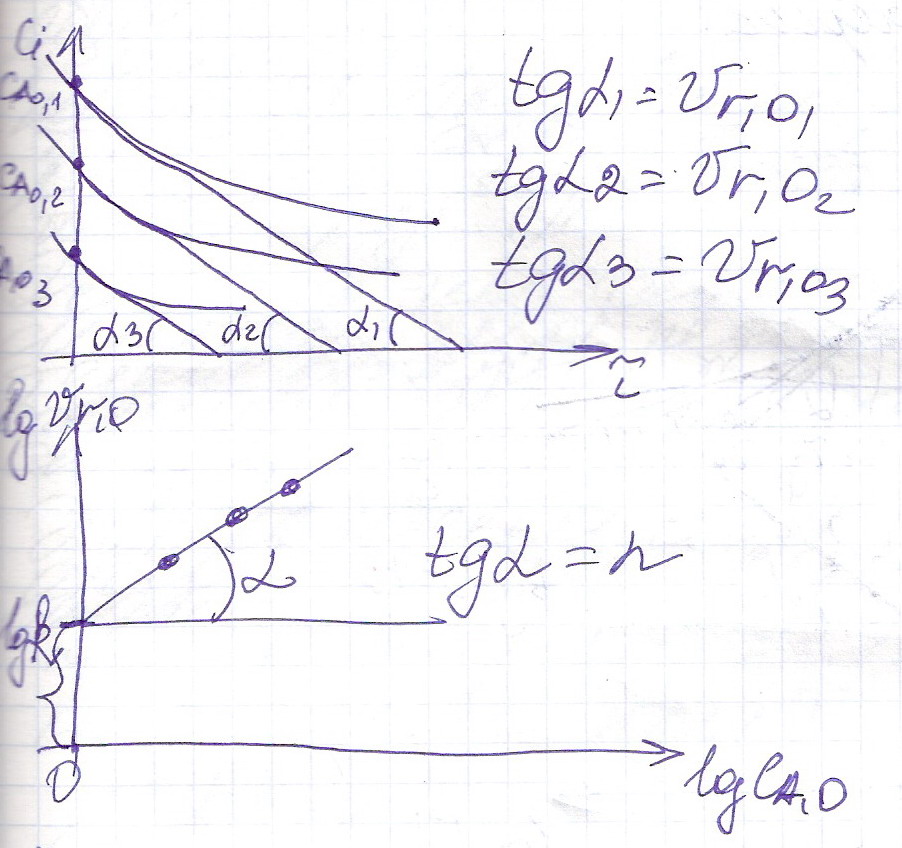
б) Аналитический
![]()
2) Метод
При использовании второго метода экспериментально определяется зависимость C i =f (τ) и графически или аналитически рассчитывается скорость химических реакций для разных текущих значений реакций i – ого реагента.
а) Графически.
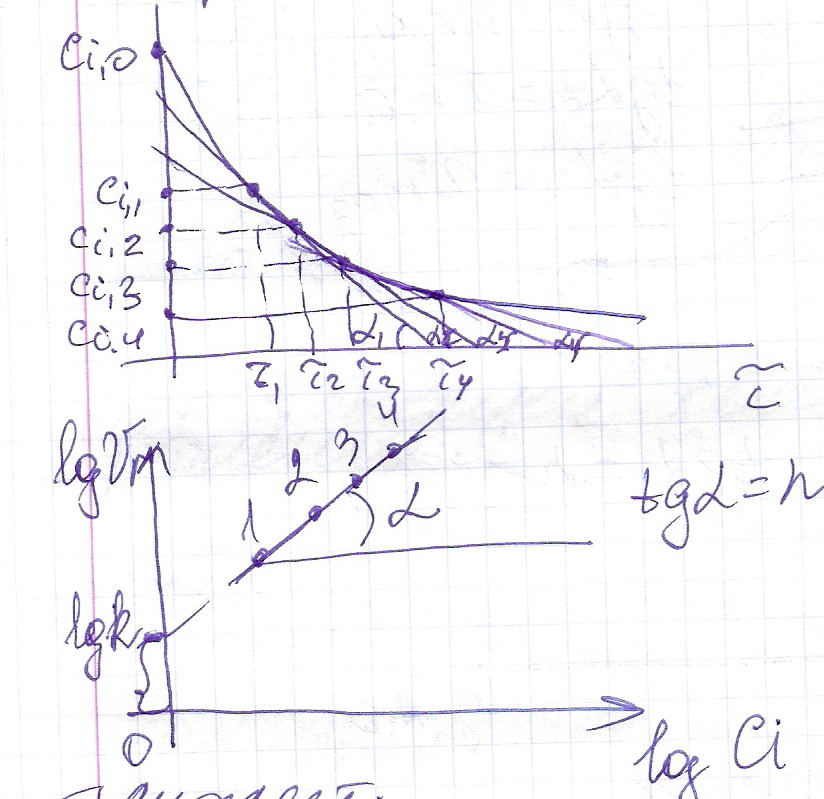
б) Аналитически
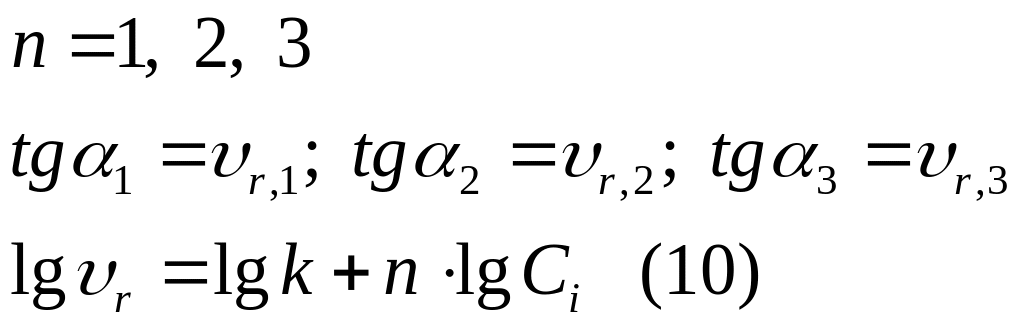
Зависимость скорости химической реакции от температуры. Общее кинетическое уравнение.
Скорость химической реакции обычно растет с повышением температуры. Как показывает опыт при повышении температуры на 10 0 С, скорость химической реакции возрастает в два или более раз.
Для характеристики зависимости скорости химической реакции от температуры был введен температурный коэффициент скорости реакции. Этот коэффициент есть отношение констант скоростей химической реакции при температуре Т = +10 и константе при Т.
![]()
Пользуясь температурным коэффициентом можно рассчитать константы скорости химической реакции при различных температурах.
Наиболее точную зависимость скорости химической реакции от Т, предположил Аррениус.
![]()
R – газовая постоянная;
Е – энергия активации.
Энергия активации – это тип энергии превышающая энергию нейтральных молекул при которой начинается химическая реакция.
Если разделить переменные и взять неопределенный интеграл, то получим
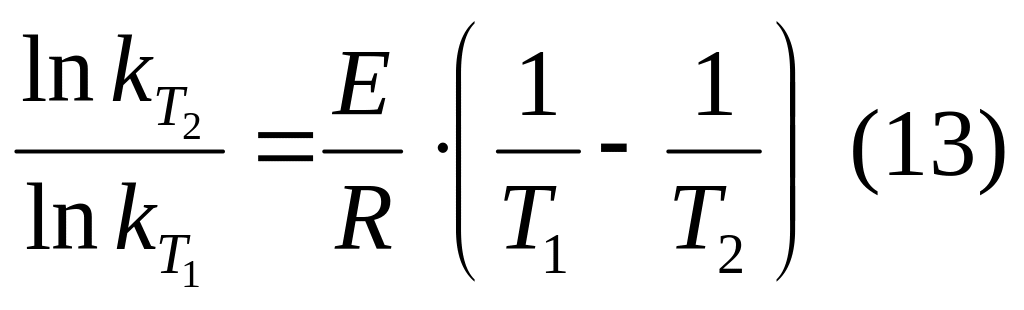
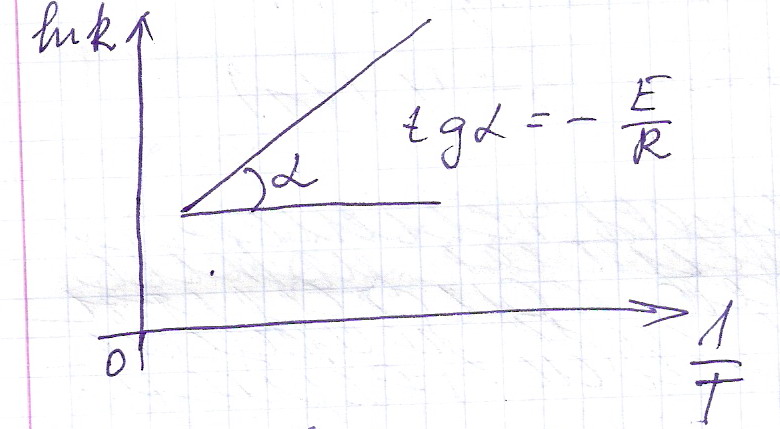
Если разделить переменные в дифференциальном уравнении 12, а затем потенцировать, получим:
![]()
А – предэкспотенциальный множитель, или постоянная Аррениуса.
Используя уравнение (14) скорость химической реакции может быть представлена в виде:
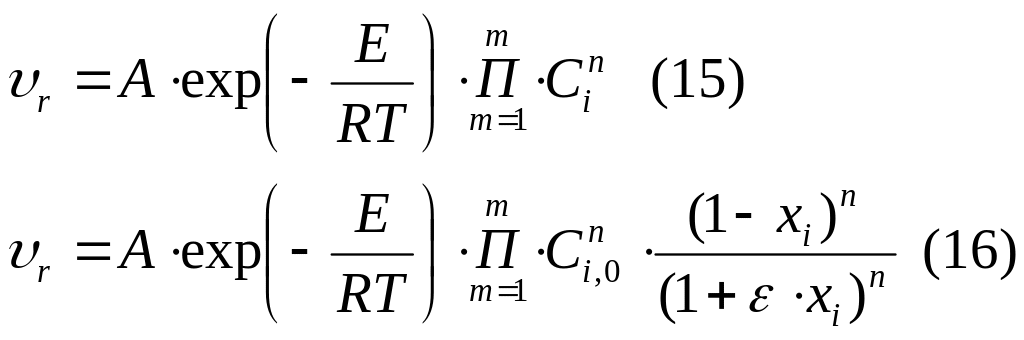
(16) – основной закон кинетики.
В уравнении (16) необходимо определить следующие постоянные величины А, E, n. n – порядок реакции.
На практике эти постоянные величины определяют только экспериментальным путем.
§2 Исследование кинетики гомогенных химических реакций.
Для определения константы скорости энергии активации и порядка химической реакции выполняют эксперименты в два этапа:
В начале при постоянной температуре снимают кинетическую зависимость
C i =f (τ) при Т1 , C i,0 , и определяют порядок реакции (n) , k1 .
2) При Т2 , C i,0 = const, снимают кинетическую зависимость C i =f(τ). Можно получить k2 .
При Т3 , C i,0 = const, снимают кинетическую зависимость C i =f(τ). Можно получить k3 .
По экспериментальной зависимости k=f (T), графическим путем ln k = f(1/T) получим энергию активации (Е акт.) и предэкспотенциальный множитель А.
Исследование гомогенных химических реакций в реакторах периодического действия емкостного типа.
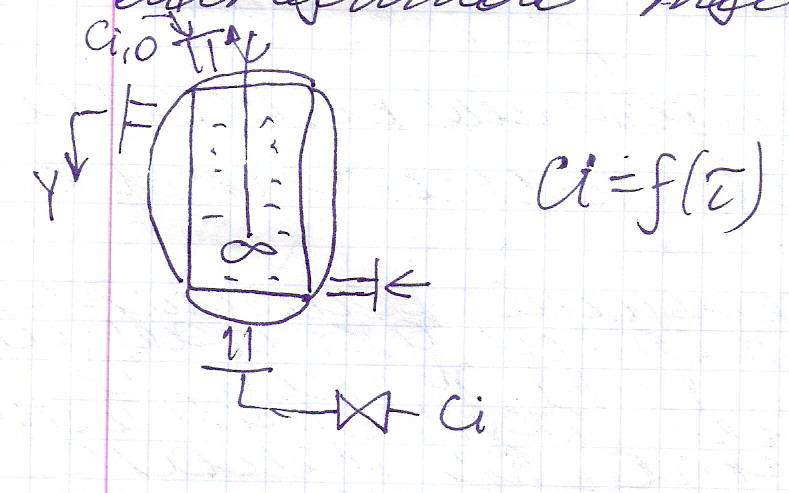

Затем, анализируем полученные экспериментальные данные интегральным и дифференциальным методом.
Интегральный метод анализа кинетической зависимости.
Этот метод анализа заключается в проверке предполагаемого кинетического уравнения интегрированием и последующим сравнением предполагаемой и экспериментальной зависимости. F(c)=f (τ).
Вообщем этот метод заключается в следующем:
1) Предполагают механизм реакции и записывают соответствующее выражение скорости. Это уравнение в общем случае имеет вид:
![]()
2) В уравнении (1) делят переменные
![]()
3) Интегрируем левую и правую часть уравнения (2)
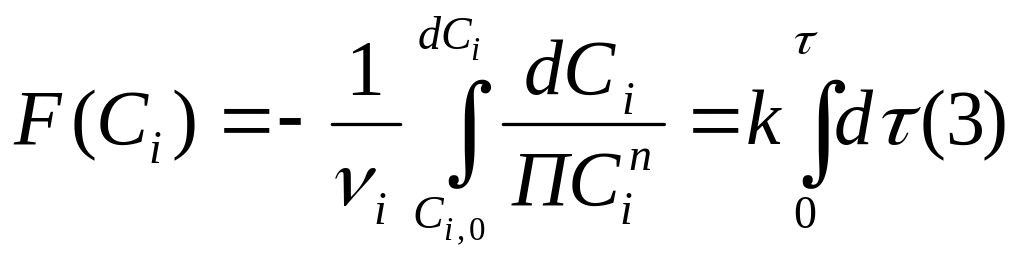
Если интеграл первой части уравнения (3) трудно найти аналитически, то можно использовать графический метод. Он заключается в определении площади под кривой.
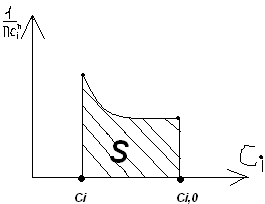
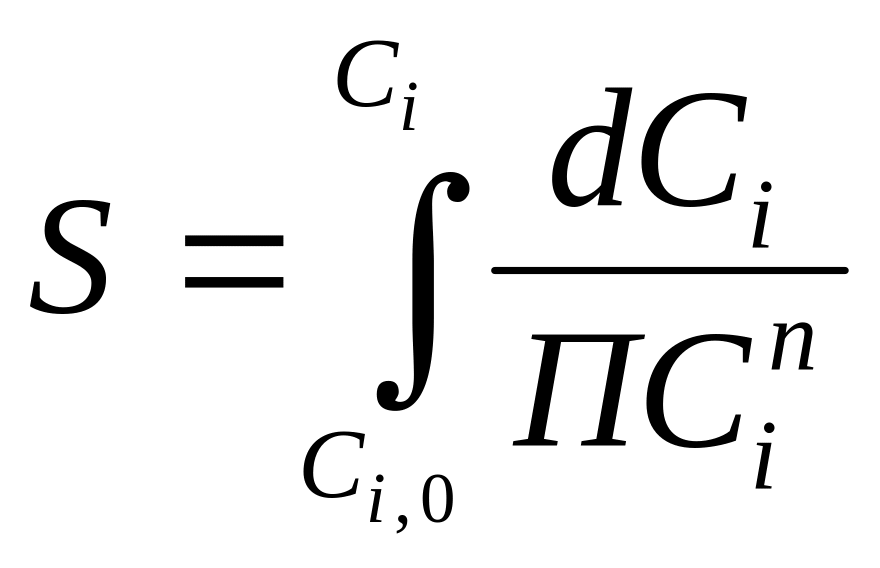
4)По экспериментальным значениям
концентрации компонентов определяют
численное значение функции F(Ci)
для различных моментов времени. Строим
график зависимости F(Ci)=f(τ).
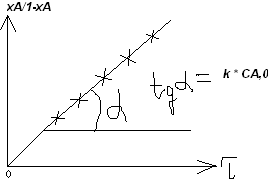
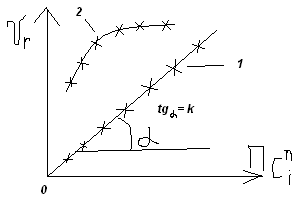
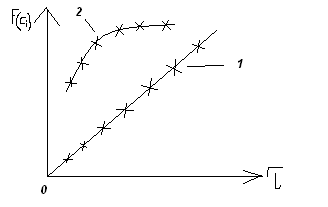 Если на графике получена прямая линия
«1», проходящая через начало координат,
то предлагаемое уравнение «1» согласуется
с экспериментальным данным. tgα,
который образует эта прямая с осью
абсцисс, будет равен константе скорости
химической реакции. Если экспериментальные
точки не образуют прямую линию, а кривую
два, то необходимо испытать другие
уравнения пока не будет получено
удовлетворительное соответствие.
Интегральный метод удобен для анализа
простых в кинетическом отношении
химических реакций.
Если на графике получена прямая линия
«1», проходящая через начало координат,
то предлагаемое уравнение «1» согласуется
с экспериментальным данным. tgα,
который образует эта прямая с осью
абсцисс, будет равен константе скорости
химической реакции. Если экспериментальные
точки не образуют прямую линию, а кривую
два, то необходимо испытать другие
уравнения пока не будет получено
удовлетворительное соответствие.
Интегральный метод удобен для анализа
простых в кинетическом отношении
химических реакций.
Пример 1: Пусть в системе протекает
реакция
![]() ,
то
,
то
1)Предположим, что по механизмам эта
реакция относится к реакциям первого
порядка
![]() ;
2) Разделим переменные и проинтегрируем:
;
2) Разделим переменные и проинтегрируем:
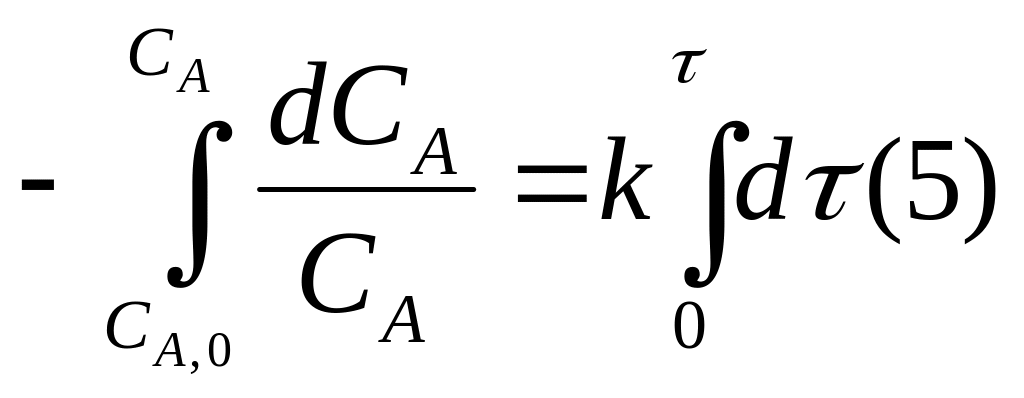 .
3)Интегрируя выражение (5) получим,
.
3)Интегрируя выражение (5) получим,
![]() .
4) Найдем значение F(CA)
из кинетической кривой и строим график.
.
4) Найдем значение F(CA)
из кинетической кривой и строим график.
 Таким образом, реакция считается реакцией
1-ого порядка и уравнение (4) адекватно
отражает этот процесс. В химической
технологии кинетическое уравнение
обычно выражают через степень превращения.
Таким образом, реакция считается реакцией
1-ого порядка и уравнение (4) адекватно
отражает этот процесс. В химической
технологии кинетическое уравнение
обычно выражают через степень превращения.
![]() ,
тогда уравнение (4) принимает вид:
,
тогда уравнение (4) принимает вид:
![]() ,
интегрируя это уравнение получим:
,
интегрируя это уравнение получим:
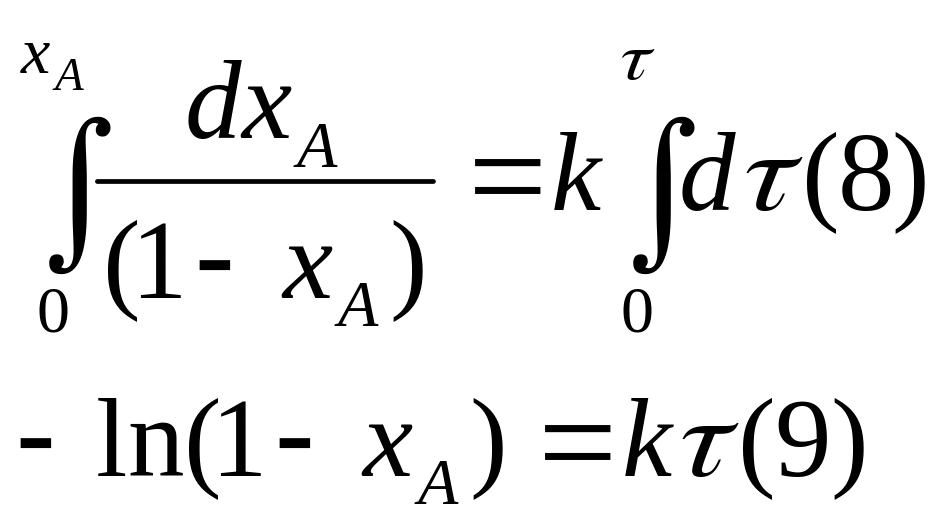 (9) эквивалентно выражению (6).
(9) эквивалентно выражению (6).
График зависимости
![]() ,
также будет прямая линия проходящая
через начало координат.
,
также будет прямая линия проходящая
через начало координат.
Пример 2: Реакция второго порядка:
![]() ,
так как реакция второго порядка при
одинаковых начальных концентрациях,
то уравнение скорости можно записать:
1)
,
так как реакция второго порядка при
одинаковых начальных концентрациях,
то уравнение скорости можно записать:
1)
![]() ;
2)
;
2)
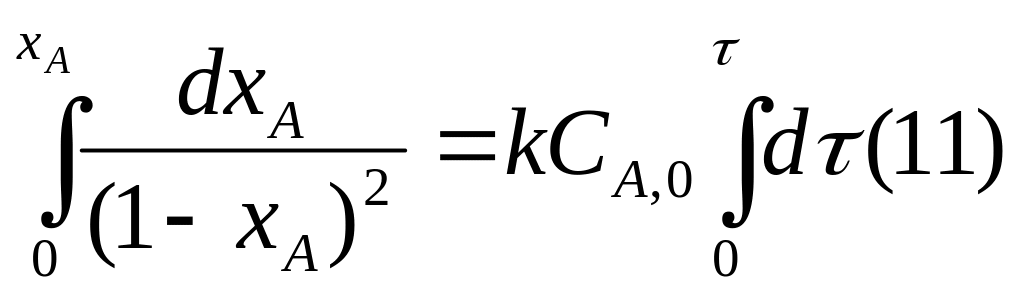 ;
3)
;
3)
![]()
 ;
4)
;
4)
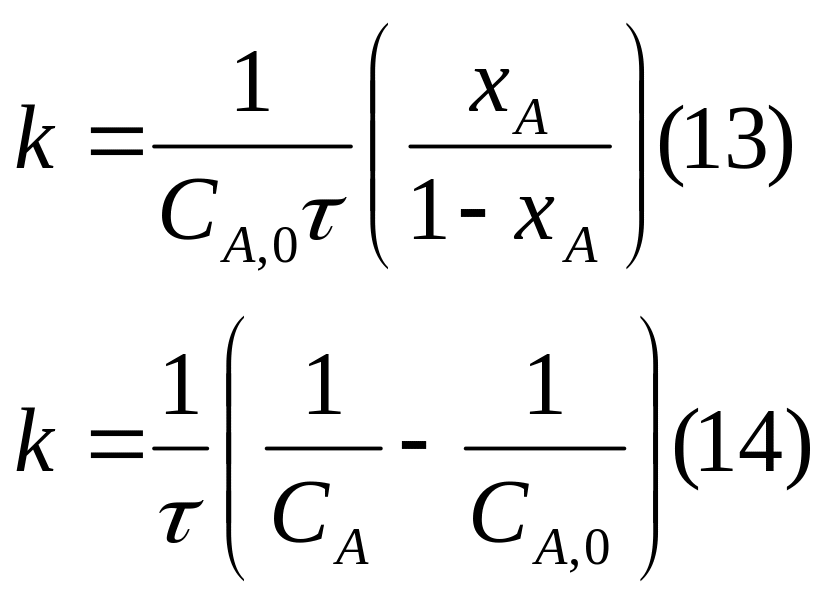
Дифференциальный метод анализа кинетических зависимостей.
Дифференциальный метод заключается в
непосредственной проверке дифференциальной
формы кинетического уравнения. Для
этого по кинетической зависимости Ci
= f(τ),
определяют все члены уравнения, включающая
производную dCi
/dτ. 1) Предполагают
механизм реакции и записывают кинетическое
уравнение:
![]() .
2) По экспериментальной кривой изменения
концентрации реагирующих веществ от
времени Ci
= f(τ),
графическим дифференцированием находят
значение dCi/dτ
в различные моменты времени и
соответствующие этим скоростям значения
концентрации Ci
.
.
2) По экспериментальной кривой изменения
концентрации реагирующих веществ от
времени Ci
= f(τ),
графическим дифференцированием находят
значение dCi/dτ
в различные моменты времени и
соответствующие этим скоростям значения
концентрации Ci
.
 3)
По этим данным вычисляют произведение
Ci
и строят график зависимости скорости
от произведения
3)
По этим данным вычисляют произведение
Ci
и строят график зависимости скорости
от произведения
![]() .
.
 .
Если получают прямую линию «1», проходящую
через начало координат, то это значит,
что уравнение скорости 1 соответствует
экспериментальным данным, а механизм
реакции удовлетворяется настолько,
насколько он подтверждается кинетикой
процесса. Если график не является прямой,
проходящей через начало координат, то
следует рассмотреть другой механизм
реакции.
.
Если получают прямую линию «1», проходящую
через начало координат, то это значит,
что уравнение скорости 1 соответствует
экспериментальным данным, а механизм
реакции удовлетворяется настолько,
насколько он подтверждается кинетикой
процесса. Если график не является прямой,
проходящей через начало координат, то
следует рассмотреть другой механизм
реакции.
