
- •Федеральное агентство по образованию
- •Микробиология производства хлебопекарных дрожжей
- •Введение
- •1. Характеристика хлебопекарных дрожжей
- •1.1. Строение дрожжевой клетки
- •1.2. Размножение дрожжевых клеток
- •1.3. Химический состав дрожжей
- •Элементный состав сухого вещества дрожжей (массовая доля, % от св дрожжей)
- •1.4. Факторы, влияющие на метаболизм дрожжей Питательные вещества
- •Аминокислотный состав свекловичной мелассы
- •Содержание витаминов в дрожжах, их роль в обмене веществ
- •Содержание ростовых веществ в мелассе
- •Минеральные вещества
- •Ферменты
- •Физико-химические условия
- •Количество вредных веществ, влияющее на рост и размножение дрожжей
- •2. Ведение коллекции штаммов хлебопекарных дрожжей
- •2.1. Определение видовой принадлежности дрожжей
- •2.2. Микробиологический анализ музейных культур
- •2.3. Изучение производственной ценности культур дрожжей
- •2.4. Промышленные штаммы хлебопекарных дрожжей
- •Характеристика промышленных штаммов хлебопекарных дрожжей
- •Паспорт штамма хлебопекарных дрожжей
- •4. Автор или авторский коллектив
- •6. Способ хранения штамма и состав среды:
- •7. Культурально-морфологические особенности:
- •8. Физиолого-биохимические особенности:
- •10. Технологические показатели:
- •11. Особые свойства:
- •Устойчивость дрожжей разных штаммов к мелассе
- •3. Оценка физиологического состояния дрожжей в процессе размножения
- •3.1. Количество почкующихся клеток
- •3.2. Размеры дрожжевых клеток
- •3.3. Количество нежизнеспособных клеток
- •3.4. Характер зернистости клеток
- •3.5. Особенности роста дрожжей
- •4. Микроорганизмы-контаминанты дрожжевого производства
- •4.1. Бактерии
- •Бактерии группы кишечной палочки
- •4.2. Посторонние дрожжи
- •Аспорогенные дрожжи
- •Спорообразующие дрожжи
- •4.3. Мицелиальные грибы
- •5. Влияние посторонней микрофлоры на выход и качество пекарских дрожжей
- •5.1. Влияние бактерий на дрожжи
- •5.2. Влияние посторонних дрожжей на пекарские дрожжи
- •Ферментация некоторых углеводов различными видами диких дрожжей
- •5.3. Влияние мицелиальных грибов на качество дрожжей
- •6. Пути попадания посторонних микроорганизмов в дрожжевое производство
- •6.1. Микрофлора мелассы
- •6.2. Микрофлора солей
- •6.3. Микрофлора воды
- •Нормативные показатели безопасности питьевой воды
- •6.4. Микрофлора воздуха
- •Основные представители микрофлоры воздуха
- •6.5. Микрофлора оборудования
- •7. Методы выявления посторонних микроорганизмов в различных объектах дрожжевого производства
- •7.1. Выявление посторонних микроорганизмов в дрожжах
- •Микробиологические показатели
- •7.2. Микробиологический контроль мелассы
- •7.3. Микробиологический контроль воздуха
- •7.4. Периодичность проведения микробиологического анализа объектов дрожжевого производства
- •Периодичность проведения микробиологических анализов
- •8. Способы предотвращения контаминации дрожжевого призводства
- •8.1. Обеспложивание мелассы
- •8.2. Асептические условия выращивания дрожжей на лабораторных стадиях
- •8.3. Стерилизация микробиологических инструментов, посуды и материалов
- •Продолжительность стерилизации посуды различной вместимости
- •8.4. Стерилизация питательных сред
- •Зависимость температуры от давления пара в автоклаве
- •Температура плавления и цвет химических веществ-индикаторов
- •8.5. Правила работы в микробиологической лаборатории
- •8.6. Основные приемы работы с культурой дрожжей лаборатории
- •8.7. Очистка технически чистой культуры дрожжей от бактерий
- •8.8. Обеззараживание воды
- •8.9. Обеззараживание сжатого воздуха
- •8.10. Способы снижения микробной контаминации воздуха производственных помещений
- •Режимы стерилизации резервуаров различного объема
- •Режимы дезинфекции помещений
- •8.11. Предотвращение развития мицелиальных грибов
- •Режимы применения полигуанидинов
- •9. Мойка производственного оборудования
- •9.1. Виды мойки
- •9.2. Механические аспекты мойки
- •9.3. Моющие средства
- •Щелочные моющие средства
- •Кислотные моющие средства
- •Характеристика моющих средств
- •РН моющих средств
- •Препараты для пенной мойки
- •Препараты для пенной мойки оборудования
- •10. Дезинфекция оборудования и коммуникаций
- •10.1. Механизм действия дезинфицирующих веществ на микробную клетку
- •Механизм действия дезинфицирующих веществ
- •Характеристика дезинфицирующих средств
- •Воздействие на микроорганизмы некоторых дезинфицирующих веществ
- •10.2. Дезинфицирующие препараты
- •11. Средства, сочетающие моющий и дезинфицирующий эффекты
- •11.1. Хлорсодержащие препараты
- •11.2. Щелочные средства
- •Моющие и дезинфицирующие щелочные средства
- •11.3. Средства для кислотной мойки и дезинфекции
- •12. Порядок санитарной обработки оборудования
- •12.1. Асептические мероприятия на стадии выращивания технически чистой культуры дрожжей
- •Продолжительность обработки оборудования
- •12.2. Обработка аппаратов для выращивания коммерческих дрожжей
- •Режим санитарной обработки товарных аппаратов
- •12.3. Аппараты для приготовления и подачи растворов мелассы и минеральных солей
- •Продолжительность санитарной обработки
- •12.4. Санитарная обработка сборников дрожжевого концентрата
- •Продолжительность санитарной обработки сборников дрожжевого концентрата
- •12.5. Кларификаторы (сепараторы растворов мелассы)
- •12.6. Сепараторы для дрожжей
- •12.7. Вакуум-фильтры
- •12.8. Трубопроводы
- •14. Контроль микробиологической чистоты оборудования
- •14.1. Традиционные методы контроля
- •Последовательность проверки чистоты оборудования и коммуникаций
- •14.2. Современные методы контроля
- •15. Возможные риски контаминации дрожжевого производства
- •Порядок микробиологического анализа при выявлении источников инфекции в производстве пекарских дрожжей
- •16. Санитарно-гигиенические требования к дрожжевому предприятию
- •16.1. Санитарные требования к территории
- •16.2. Требования к производственным зданиям
- •Требования к освещению
- •Требования к отоплению и вентиляции
- •Санитарные требования к водоснабжению и канализации
- •16.3. Санитарные требования к производственному оборудованию и технологическому процессу
- •16.4. Санитарные требования к сырью и условиям его хранения
- •16.5. Требования к готовой продукции, ее хранению и транспортировке
- •16.6. Требования к хранению моющих и дезинфицирующих средств
- •16.7. Правила личной и производственной гигиены работников дрожжевых предприятий
- •16.8. Ответственность за соблюдение санитарных правил
- •17. Питательные среды для выявления посторонних микроорганизмов
- •17.1. Приготовление питательных сред
- •Индикаторы рН для питательных сред
- •Условия и сроки хранения лабораторных сред
- •Список литературы
- •Содержание
- •Микробиология производства хлебопекарных дрожжей
2.1. Определение видовой принадлежности дрожжей
Для идентификации дрожжей необходимо исследование комплекса морфологических и физиологических признаков. Морфологические свойства включают образование аскоспор, характер вегетативного размножения, форму и размер клеток, макроморфологические признаки.
Образование аскоспор. Дрожжи образуют споры на плотных средах, обедненных какими-либо питательными веществами. Для выявления спор используют специальные среды, среди которых наиболее распространенной является среда Городковой (10 г пептона, 5 г хлорида натрия, 1 г глюкозы, 20 г агара, водопроводная вода до 1 л; рН среды 7,3.Исследуемые культуры наносят штрихом на поверхность скошенной в пробирках среды и инкубируют при 30 С в течение 7 сут, после чего просматривают под микроскопом.
Макроморфологические признаки дрожжей изучают по внешнему виду колоний и форме штриха на солодовом агаре после инкубации в течение 7 сут при 30 С. При описании колоний отмечают их вид, цвет, размер, форму, поверхностный узор.
При изучении физиологических свойств отмечают образование пленки в жидкой питательной среде, ферментацию сахаров; ассимиляцию углеводов, спиртов, органических кислот и нитратов; образование крахмалоподобных соединений.
Образование пленки исследуют при культивировании дрожжей в жидких средах: ее толщину, «вползание» по стенке; характер пристеночного кольца, осадка, мути.
Ферментация сахаров. Способность к сбраживанию углеводов является одним из основных признаков при идентификации дрожжей. Оценку процесса ферментации проводят при культивировании дрожжей в жидкой питательной среде, в которую помещен поплавок для скопления выделяющегося при брожении газа. Для этого используют дрожжевую воду, в которую внесен один из исследуемых сахаров.
Ассимиляция углеводов, спиртов, органических кислот – также важный признак при идентификации дрожжей. Для определения способности дрожжей к ассимиляции используют следующую среду: 0,5 % (NH4)2SO4; 0,1 % KH2PO4; 0,05 % MgSO4 7H2O; 0,1 % дрожжевого автолизата, 3 % промытого агар-агара, к которой добавляют 1 % соответствующего сахара. Посев дрожжей проводят штрихом на агаризованную среду в пробирках или чашках Петри. Способность дрожжей к усвоению того или другого соединения определяют визуально по интенсивности роста в сравнении со средой без сахара.
В настоящее время для идентификации штаммов одного вида широко используют методы анализа ДНК путем электрофореза в пульсирующих разнонаправленных электрических полях (пульс-элект-рофорез). Имея размеры фрагментов ДНК, полученных при обработке нативной ДНК эндонуклеазами рестрикции и разделенных электрофорезом, возможно построить макрорестрикционные карты хромосом, которые отражают порядок расположения на хромосоме фрагментов ДНК известного размера, ограниченных сайтами рестрикции и составить физическую карту хромосомы.
2.2. Микробиологический анализ музейных культур
Периодически (не реже одного раза в квартал и перед рассылкой на дрожжевые предприятия) промышленные штаммы анализируют на микробиологическую чистоту и сохранение производственно-ценных свойств. Проверку на наличие в пробирочных культурах бактерий и посторонних дрожжей осуществляют посевом на селективные плотные питательные среды. В случае обнаружения бактерий культуру дрожжей обрабатывают антимикробными препаратами, после чего посевы на селективные среды повторяют.
При проверке музейных культур на наличие посторонних дрожжей используют синтетическую среду с лизином. Надежным способом очистки от посторонних дрожжей является рассев культур на поверхность плотной питательной среды с целью получения изолированных колоний хлебопекарных дрожжей. Для получения изолированных колоний используют один из двух следующих методов:
Рассев с помощью шпателя. Каплю дрожжевой суспензии помещают на поверхность сусло-агара в чашке Петри, равномерно растирая ее стерильным стеклянным шпателем. Затем, не обжигая шпатель в пламени горелки, растирают им последовательно поверхность второй и третьей чашки Петри.
После рассева дрожжи инкубируют при 26–28 С в течение 3–5 сут. Как правило, на поверхности питательной среды последней чашки дрожжи растут в виде изолированных колоний (рис. 2.1).
б
а
в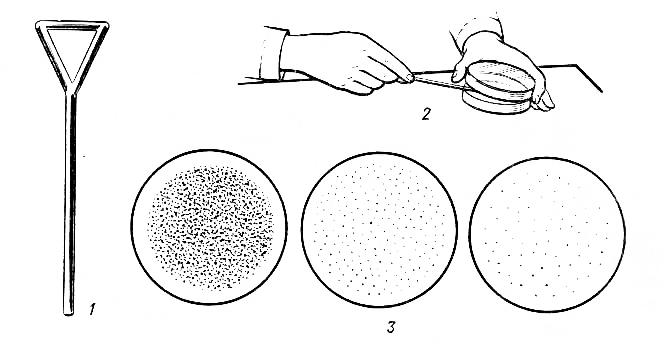
Рис. 2.1. Рассев культуры на поверхность плотной среды шпателем: а – шпатель Дригальского; б – рассев; в – рост микроорганизмов после рассева
Рассев истощающим мазком. Каплю дрожжевой суспензии с помощью микробиологической петли наносят на поверхность плотной питательной среды, содержащейся в чашке Петри, и растирают ее петлей на ¼ поверхности. Затем, не обжигая петлю в пламени горелки, в той же чашке последовательно на остальных частях среды проводят ряд штрихов. На последних штрихах дрожжи вырастают обычно в виде изолированных колоний. Дрожжи из 20–30 изолированных колоний переносят в солодовое сусло, инкубируют в течение 24 ч при температуре 26–28 С, затем пересевают на скошенный сусловой агар (рис. 2.2).

Рис. 2.2. Схемы рассева культуры петлей на поверхность плотной среды
